Namenda: Alzheimer
Namenda è un farmaco usato nel trattamento della malattia di Alzheimer. Informazioni dettagliate sull'uso, il dosaggio, gli effetti collaterali di Namenda.
Marchio: Namenda
Nome generico: Memantina cloridrato
Namenda (memantina cloridrato) è un farmaco usato nel trattamento della malattia di Alzheimer. Di seguito informazioni dettagliate su usi, dosaggio ed effetti collaterali di Namenda.
Contenuti:
Descrizione
Farmacologia
Indicazioni e utilizzo
Controindicazioni
Precauzioni
Interazioni farmacologiche
Reazioni avverse
Overdose
Dosaggio
Fornito
Istruzioni per il paziente
Namenda Informazioni paziente (in semplice inglese)
Descrizione
Namenda® (memantina cloridrato) è un antagonista del recettore NMDA attivo per via orale. Il nome chimico per memantina cloridrato è 1-ammino-3,5-dimetilladamantano cloridrato con la seguente formula strutturale:
Fonte: Forest Laboratories, distributore statunitense o Namenda.

La formula molecolare è C 12 H 21 N · HCl e il peso molecolare è 215,76.
Memantina HCl si presenta come una polvere da bianca a biancastra ed è solubile in acqua. Namenda è disponibile in compresse o in soluzione orale. Namenda è disponibile per la somministrazione orale in compresse rivestite con film a forma di capsula contenenti 5 mg e 10 mg di memantina cloridrato. Le compresse contengono anche i seguenti ingredienti inattivi: cellulosa microcristallina, lattosio monoidrato, biossido di silicio colloidale, talco e magnesio stearato. Inoltre, i seguenti ingredienti inattivi sono presenti come componenti della pellicola: ipromellosa, triacetina, biossido di titanio, FD&C giallo # 6 e FD&C blu # 2 (compresse da 5 mg), ossido di ferro nero (compresse da 10 mg). La soluzione orale di Namenda contiene memantina cloridrato in un dosaggio equivalente a 2 mg di memantina cloridrato in ogni ml. La soluzione orale contiene anche i seguenti ingredienti inattivi: soluzione di sorbitolo (70%), metil paraben, propilparabene, glicole propilenico, glicerina, aroma naturale di menta piperita # 104, acido citrico, citrato di sodio e purificato acqua.
Farmacologia clinica
Meccanismo di azione e farmacodinamica
Attivazione persistente dei recettori N-metil-D-aspartato (NMDA) del sistema nervoso centrale da parte del l'amminoacido eccitatorio glutammato è stato ipotizzato per contribuire alla sintomatologia di Il morbo di Alzheimer. La memantina è postulata per esercitare il suo effetto terapeutico attraverso la sua azione come affinità da bassa a moderata antagonista del recettore NMDA non competitivo (canale aperto) che si lega preferenzialmente al recettore NMDA operato canali cationici. Non ci sono prove che la memantina prevenga o rallenti la neurodegenerazione nei pazienti con malattia di Alzheimer.
La memantina ha mostrato un'affinità da bassa a trascurabile per i recettori GABA, benzodiazepina, dopamina, adrenergico, istamina e glicina e per i canali Ca 2+, Na + o K + dipendenti dalla tensione. Memantina ha anche mostrato effetti antagonistici sul recettore 5HT 3 con una potenza simile a quella per il recettore NMDA e bloccato i recettori dell'acetilcolina nicotinica con un sesto a un decimo potenza.
Studi in vitro hanno dimostrato che la memantina non influenza l'inibizione reversibile dell'acetilcolinesterasi da donepezil, galantamina o tacrina.
farmacocinetica
La memantina è ben assorbita dopo somministrazione orale e ha una farmacocinetica lineare nell'intervallo di dosi terapeutiche. Viene escreto principalmente nelle urine, invariato e ha un'emivita di eliminazione terminale di circa 60-80 ore.
Assorbimento e distribuzione
Dopo la somministrazione orale, la memantina viene fortemente assorbita con concentrazioni di picco raggiunte in circa 3-7 ore. Il cibo non ha alcun effetto sull'assorbimento della memantina. Il volume medio di distribuzione della memantina è di 9-11 L / kg e il legame con le proteine plasmatiche è basso (45%).
Metabolismo ed eliminazione
Memantina subisce un parziale metabolismo epatico. Circa il 48% del farmaco somministrato viene escreto immodificato nelle urine; il resto viene convertito principalmente in tre metaboliti polari che possiedono un recettore NMDA minimo attività antagonistica: coniugato N-glucuronide, 6-idrossi-memantina e 1-nitroso-deaminato memantina. Un totale del 74% della dose somministrata viene escreto come somma della droga madre e del coniugato N-glucuronide. Il sistema enzimatico microsomiale CYP450 non svolge un ruolo significativo nel metabolismo della memantina. Memantina ha un'emivita di eliminazione terminale di circa 60-80 ore. La clearance renale comporta una secrezione tubulare attiva moderata dal riassorbimento tubulare dipendente dal pH.
Popolazioni speciali
Insufficienza renale: La farmacocinetica di memantina è stata valutata in seguito a singola somministrazione orale di 20 mg di memantina HCl in 8 soggetti con insufficienza renale lieve (clearance della creatinina, CLcr,> 50 - 80 ml / min), 8 soggetti con insufficienza renale moderata (CLcr 30 - 49 ml / min), 7 soggetti con insufficienza renale grave (CLcr 5 - 29 mL / min) e 8 soggetti sani (CLcr> 80 mL / min) abbinati il più vicino possibile per età, peso e sesso ai soggetti con insufficienza renale perdita di valore. L'AUC media 0- (infinito) è aumentata del 4%, 60% e 115% nei soggetti con insufficienza renale lieve, moderata e grave, rispettivamente, rispetto ai soggetti sani. L'emivita di eliminazione terminale è aumentata del 18%, 41% e 95% nei soggetti con insufficienza renale lieve, moderata e grave, rispettivamente, rispetto ai soggetti sani.
Non è raccomandato alcun aggiustamento del dosaggio per i pazienti con insufficienza renale lieve e moderata. Il dosaggio deve essere ridotto nei pazienti con grave insufficienza renale (vedere DOSAGGIO E SOMMINISTRAZIONE).
anziano: La farmacocinetica di Namenda in soggetti giovani e anziani è simile.
Genere: Dopo la somministrazione di dosi multiple di Namenda 20 mg b.i.d., le femmine avevano un'esposizione di circa il 45% superiore rispetto ai maschi, ma non vi era alcuna differenza nell'esposizione quando si prendeva in considerazione il peso corporeo.
Interazioni farmaco-farmaco
Substrati di enzimi microsomiali: Studi in vitro hanno indicato che a concentrazioni superiori a quelle associate all'efficacia, la memantina non induce gli isozimi del citocromo P450 CYP1A2, CYP2C9, CYP2E1 e CYP3A4 / 5. Inoltre, studi in vitro hanno dimostrato che la memantina produce una minima inibizione degli enzimi CYP450 CYP1A2, CYP2A6, CYP2C9, CYP2D6, CYP2E1 e CYP3A4. Questi dati indicano che non sono attese interazioni farmacocinetiche con farmaci metabolizzati da questi enzimi.
Inibitori degli enzimi microsomiali: Poiché la memantina subisce un metabolismo minimo, con la maggior parte della dose escreta immodificata nelle urine, è improbabile un'interazione tra memantina e farmaci inibitori degli enzimi CYP450. La somministrazione concomitante di Namenda con l'inibitore AChE donepezil HCl non influenza la farmacocinetica di nessuno dei due composti.
Farmaci eliminati tramite meccanismi renali: La memantina viene eliminata in parte dalla secrezione tubulare. Studi in vivo hanno dimostrato che dosi multiple di diuretico idroclorotiazide / triamterene (HCTZ / TA) non hanno influenzato l'AUC della memantina allo stato stazionario. La memantina non ha influenzato la biodisponibilità di TA e ha ridotto l'AUC e la C max di HCTZ di circa il 20%. La somministrazione concomitante di memantina con il farmaco antiiperglicemico Glucovance® (gliburide e metformina HCl) non ha influenzato la farmacocinetica di memantina, metformina e gliburide. Memantina non ha modificato gli effetti sierici di riduzione del glucosio di Glucovance®, indicando l'assenza di un'interazione farmacodinamica.
Farmaci che rendono le urine alcaline: La clearance della memantina è stata ridotta di circa l'80% in condizioni di urina alcalina a pH 8. Pertanto, alterazioni del pH delle urine verso lo stato alcalino possono portare ad un accumulo del farmaco con un possibile aumento degli effetti avversi. I farmaci che alcalinizzano l'urina (ad es. Inibitori dell'anidrasi carbonica, bicarbonato di sodio) dovrebbero ridurre l'eliminazione renale della memantina.
Farmaci altamente legati alle proteine plasmatiche: Poiché il legame con le proteine plasmatiche della memantina è basso (45%), è improbabile un'interazione con farmaci fortemente legati alle proteine plasmatiche, come warfarin e digossina.
TEST CLINICI
L'efficacia di Namenda (memantina cloridrato) come trattamento per i pazienti con malattia di Alzheimer da moderata a grave è stata dimostrata in 2 studi randomizzati, studi clinici in doppio cieco, controllati con placebo (Studi 1 e 2) condotti negli Stati Uniti che hanno valutato sia la funzione cognitiva sia la funzione quotidiana. L'età media dei pazienti che hanno partecipato a questi due studi era di 76 anni con un intervallo di 50-93 anni. Circa il 66% dei pazienti era di sesso femminile e il 91% dei pazienti era di razza caucasica.
Un terzo studio (Studio 3), condotto in Lettonia, ha arruolato pazienti con demenza grave, ma non ha valutato la funzione cognitiva come endpoint pianificato.
Misure del risultato dello studio: in ogni studio degli Stati Uniti, l'efficacia di Namenda è stata determinata utilizzando entrambi uno strumento progettato per valutare la funzione generale attraverso la valutazione correlata al caregiver e uno strumento che misura cognizione. Entrambi gli studi hanno dimostrato che i pazienti trattati con Namenda hanno registrato un miglioramento significativo in entrambe le misure rispetto al placebo.
La funzione quotidiana è stata valutata in entrambi gli studi utilizzando lo studio cooperativo sulla malattia di Alzheimer modificato - Inventario delle attività della vita quotidiana (ADCS-ADL). ADCS-ADL è costituito da una serie completa di domande ADL utilizzate per misurare le capacità funzionali dei pazienti. Ogni articolo ADL è valutato dal più alto livello di prestazioni indipendenti per completare la perdita. L'investigatore esegue l'inventario intervistando un caregiver che abbia familiarità con il comportamento del paziente. Un sottoinsieme di 19 articoli, inclusi i punteggi relativi alla capacità del paziente di mangiare, vestirsi, fare il bagno, telefono, viaggiare, fare acquisti, ed eseguire altre faccende domestiche è stato validato per la valutazione di pazienti con moderato a grave demenza. Questo è l'ADCS-ADL modificato, che ha un intervallo di punteggio da 0 a 54, con i punteggi più bassi che indicano una maggiore compromissione funzionale.
La capacità di Namenda di migliorare le prestazioni cognitive è stata valutata in entrambi gli studi con Severe Impairment Battery (SIB), un strumento multi-articolo che è stato validato per la valutazione della funzione cognitiva in pazienti con moderato a grave demenza. La SIB esamina aspetti selezionati della prestazione cognitiva, inclusi elementi di attenzione, orientamento, linguaggio, memoria, capacità visuospaziale, costruzione, prassi e interazione sociale. L'intervallo del punteggio SIB è compreso tra 0 e 100, con punteggi più bassi che indicano una maggiore compromissione cognitiva.
Studio 1 (studio di ventotto settimane)
In uno studio della durata di 28 settimane, 252 pazienti con malattia di Alzheimer da moderata a grave (diagnosticata da DSM-IV e NINCDS-ADRDA criteri, con punteggi dell'esame di stato mini-mentale> / = 3 e! - = 14 e fasi di scala del deterioramento globale 5-6) sono stati randomizzati a Namenda o placebo. Per i pazienti randomizzati a Namenda, il trattamento è stato iniziato a 5 mg una volta al giorno e aumentato settimanalmente di 5 mg / die in dosi divise ad una dose di 20 mg / die (10 mg due volte al giorno).
Effetti sull'ADCS-ADL:
La Figura 1 mostra il decorso temporale per il cambiamento rispetto al basale del punteggio ADCS-ADL per i pazienti nei due gruppi di trattamento che hanno completato le 28 settimane dello studio. A 28 settimane di trattamento, la differenza media nei punteggi di cambiamento ADCS-ADL per i pazienti trattati con Namenda rispetto ai pazienti trattati con placebo era 3,4 unità. Utilizzando un'analisi basata su tutti i pazienti e portando avanti la loro ultima osservazione di studio (analisi LOCF), il trattamento con Namenda è stato statisticamente significativamente superiore al placebo.
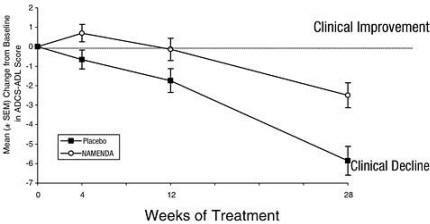
Figura 1: andamento temporale della variazione rispetto al basale del punteggio ADCS-ADL per i pazienti che hanno completato 28 settimane di trattamento.
La Figura 2 mostra le percentuali cumulative di pazienti di ciascuno dei gruppi di trattamento che avevano raggiunto almeno la variazione dell'ADCS-ADL mostrata sull'asse X.
Le curve mostrano che entrambi i pazienti assegnati a Namenda e al placebo hanno una vasta gamma di risposte e generalmente mostrano un deterioramento (a variazione negativa in ADCS-ADL rispetto al basale), ma è più probabile che il gruppo Namenda mostri un calo minore o un miglioramento. (In una visualizzazione di distribuzione cumulativa, una curva per un trattamento efficace verrebbe spostata a sinistra della curva per placebo, mentre un trattamento inefficace o deleterio sarebbe sovrapposto o spostato a destra della curva per placebo.)

Figura 2: percentuale cumulativa di pazienti che hanno completato 28 settimane di trattamento in doppio cieco con variazioni specificate rispetto al basale nei punteggi ADCS-ADL.
Effetti sulla SIB: la Figura 3 mostra il decorso temporale del cambiamento rispetto al basale del punteggio SIB per i due gruppi di trattamento nelle 28 settimane dello studio. A 28 settimane di trattamento, la differenza media nei punteggi di cambiamento SIB per i pazienti trattati con Namenda rispetto ai pazienti trattati con placebo era di 5,7 unità. Utilizzando un'analisi LOCF, il trattamento con Namenda era statisticamente significativamente superiore al placebo.
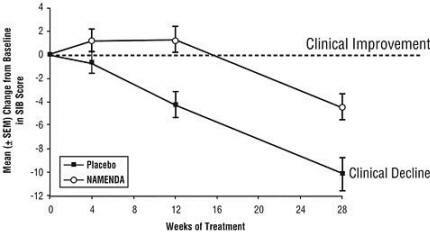
Figura 3: andamento temporale della variazione rispetto al basale del punteggio SIB per i pazienti che hanno completato 28 settimane di trattamento.
La Figura 4 mostra le percentuali cumulative di pazienti di ciascun gruppo di trattamento che avevano raggiunto almeno la misura del cambiamento nel punteggio SIB mostrato sull'asse X.
Le curve mostrano che entrambi i pazienti assegnati a Namenda e al placebo hanno una vasta gamma di risposte e generalmente mostrano un peggioramento, ma è più probabile che il gruppo Namenda mostri un calo o un calo minore miglioramento.

Figura 4: percentuale cumulativa di pazienti che hanno completato 28 settimane di trattamento in doppio cieco con variazioni specifiche rispetto al basale nei punteggi SIB.
Studio 2 (studio di ventiquattro settimane) In uno studio della durata di 24 settimane, 404 pazienti con moderato a grave probabile malattia di Alzheimer (diagnosticata secondo i criteri NINCDS-ADRDA, con esame dello stato mini-mentale punteggi ≥ 5 e ≤ 14) che erano stati trattati con donepezil per almeno 6 mesi e che avevano assunto una dose stabile di donepezil negli ultimi 3 mesi è stato randomizzato a Namenda o placebo mentre riceveva ancora donepezil. Per i pazienti randomizzati a Namenda, il trattamento è stato iniziato a 5 mg una volta al giorno e aumentato settimanalmente di 5 mg / die a dosi divise ad una dose di 20 mg / die (10 mg due volte al giorno).
Effetti sull'ADCS-ADL: la Figura 5 mostra l'andamento temporale della variazione rispetto al basale del punteggio ADCS-ADL per i due gruppi di trattamento nelle 24 settimane dello studio. A 24 settimane di trattamento, la differenza media nei punteggi di cambiamento ADCS-ADL per Namenda / donepezil i pazienti trattati (terapia di combinazione) rispetto ai pazienti trattati con placebo / donepezil (monoterapia) sono stati 1,6 unità. Utilizzando un'analisi LOCF, il trattamento con Namenda / donepezil è stato statisticamente significativamente superiore al placebo / donepezil.
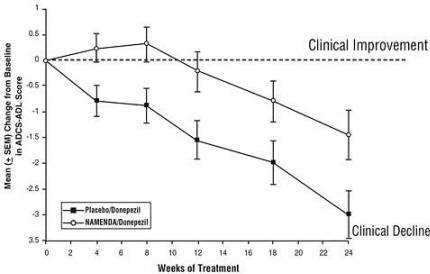
Figura 5: andamento temporale della variazione rispetto al basale del punteggio ADCS-ADL per i pazienti che hanno completato 24 settimane di trattamento.
La Figura 6 mostra le percentuali cumulative di pazienti di ciascuno dei gruppi di trattamento che avevano raggiunto almeno la misura di miglioramento dell'ADCS-ADL mostrata sull'asse X.
Le curve mostrano che entrambi i pazienti assegnati a Namenda / donepezil e placebo / donepezil hanno una vasta gamma di risposte e generalmente mostrano un deterioramento, ma è più probabile che il gruppo Namenda / donepezil mostri un calo minore o un miglioramento.

Figura 6: percentuale cumulativa di pazienti che completano 24 settimane di trattamento in doppio cieco con variazioni specificate rispetto al basale nei punteggi ADCS-ADL.
Effetti sulla SIB: la Figura 7 mostra l'andamento temporale del cambiamento rispetto al basale del punteggio SIB per i due gruppi di trattamento durante le 24 settimane dello studio. A 24 settimane di trattamento, la differenza media nei punteggi di cambiamento SIB per i pazienti trattati con Namenda / donepezil rispetto ai pazienti trattati con placebo / donepezil era di 3,3 unità. Utilizzando un'analisi LOCF, il trattamento con Namenda / donepezil è stato statisticamente significativamente superiore al placebo / donepezil.

Figura 7: andamento temporale della variazione rispetto al basale del punteggio SIB per i pazienti che hanno completato 24 settimane di trattamento.
La Figura 8 mostra le percentuali cumulative di pazienti di ciascun gruppo di trattamento che avevano raggiunto almeno la misura del miglioramento del punteggio SIB mostrato sull'asse X.
Le curve mostrano che entrambi i pazienti assegnati a Namenda / donepezil e placebo / donepezil hanno una vasta gamma di risposte, ma è più probabile che il gruppo Namenda / donepezil mostri un miglioramento o una riduzione declino.
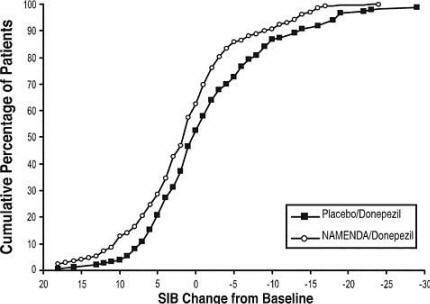
Figura 8: percentuale cumulativa di pazienti che completano 24 settimane di trattamento in doppio cieco con variazioni specificate rispetto al basale nei punteggi SIB.
Studio 3 (studio di dodici settimane) In uno studio in doppio cieco della durata di 12 settimane, condotto in case di cura in Lettonia, 166 pazienti con demenza secondo a DSM-III-R, un punteggio di esame dello stato mini-mentale di <10 e una stadiazione della scala di deterioramento globale da 5 a 7 sono stati randomizzati a Namenda o placebo. Per i pazienti randomizzati a Namenda, il trattamento è stato iniziato a 5 mg una volta al giorno e aumentato a 10 mg una volta al giorno dopo 1 settimana. Le misure di efficacia primaria erano la sottoscala della dipendenza dalla cura della scala di valutazione comportamentale per i pazienti geriatrici (BGP), una misura della funzione quotidiana e un'impressione clinica globale di cambiamento (CGI-C), una misura della clinica complessiva effetto. In questo studio non è stata utilizzata alcuna misura valida della funzione cognitiva. Una differenza di trattamento statisticamente significativa a 12 settimane che ha favorito Namenda rispetto al placebo è stata osservata in entrambe le misure di efficacia primaria. Poiché i pazienti entrati erano una miscela di malattia di Alzheimer e demenza vascolare, è stato fatto un tentativo di distinguere i due gruppi e tutti i pazienti sono stati successivamente designati come affetti da demenza vascolare o morbo di Alzheimer, in base ai loro punteggi sulla scala ischemica di Hachinski allo studio iscrizione. Solo circa il 50% dei pazienti presentava una tomografia computerizzata del cervello. Per il sottogruppo designato come affetto dalla malattia di Alzheimer, è stato osservato un effetto statisticamente significativo del trattamento a favore di Namenda rispetto al placebo a 12 settimane sia sulla BGP che sulla CGI-C.
Indicazioni e utilizzo
Namenda (memantina cloridrato) è indicata per il trattamento della demenza da moderata a grave di tipo Alzheimer.
Controindicazioni
Namenda (memantina cloridrato) è controindicata nei pazienti con nota ipersensibilità alla memantina cloridrato o ad eventuali eccipienti utilizzati nella formulazione.
Precauzioni
Informazioni per pazienti e operatori sanitari: Gli operatori sanitari devono essere istruiti nella somministrazione raccomandata (due volte al giorno per dosi superiori a 5 mg) e nell'aumento della dose (intervallo minimo di una settimana tra gli aumenti della dose).
Convulsioni di condizioni neurologiche:
Namenda non è stata valutata sistematicamente in pazienti con disturbo convulsivo. Negli studi clinici su Namenda, si sono verificate convulsioni nello 0,2% dei pazienti trattati con Namenda e nello 0,5% dei pazienti trattati con placebo.
Condizioni genito-urinarie
Le condizioni che aumentano il pH delle urine possono ridurre l'eliminazione urinaria di memantina con conseguente aumento dei livelli plasmatici di memantina.
Popolazioni speciali
Insufficienza epatica
Namenda subisce un metabolismo epatico parziale, con circa il 48% della dose somministrata escreta nelle urine come farmaco immodificato o come somma della droga madre e del coniugato N-glucuronide (74%). La farmacocinetica della memantina nei pazienti con insufficienza epatica non è stata studiata, ma ci si aspetta che ne sia influenzata solo modestamente.
Insufficienza renale
Non è necessario alcun aggiustamento del dosaggio nei pazienti con insufficienza renale lieve o moderata. Si raccomanda una riduzione del dosaggio nei pazienti con grave insufficienza renale (vedere FARMACOLOGIA CLINICA e DOSAGGIO E SOMMINISTRAZIONE ).
Interazioni farmaco-farmaco
N-metil-D-aspartato (NMDA) antagonisti: l'uso combinato di Namenda con altri antagonisti NMDA (amantadina, ketamina e destrometorfano) non è stato valutato sistematicamente e tale uso deve essere affrontato con cautela.
Effetti di Namenda su substrati di enzimi microsomiali: Studi in vitro condotti con substrati marcatori degli enzimi CYP450 (CYP1A2, -2A6, -2C9, -2D6, -2E1, -3A4) hanno mostrato una minima inibizione di questi enzimi da parte della memantina. Inoltre, studi in vitro indicano che a concentrazioni superiori a quelle associate all'efficacia, la memantina non induce gli isozimi del citocromo P450 CYP1A2, CYP2C9, CYP2E1 e CYP3A4 / 5. Non sono attese interazioni farmacocinetiche con farmaci metabolizzati da questi enzimi.
Effetti di inibitori e / o substrati di enzimi microsomiali su Namenda: La memantina viene eliminata principalmente per via renale e non è previsto che i farmaci che sono substrati e / o inibitori del sistema CYP450 alterino il metabolismo della memantina.
Inibitori dell'acetilcolinesterasi (AChE): La somministrazione concomitante di Namenda con l'inibitore AChE donepezil HCl non ha influenzato la farmacocinetica di entrambi i composti. In uno studio clinico controllato di 24 settimane in pazienti con malattia di Alzheimer da moderata a grave, gli avversi il profilo dell'evento osservato con una combinazione di memantina e donepezil era simile a quello del solo donepezil.
Farmaci eliminati tramite meccanismi renali: Poiché la memantina viene eliminata in parte dalla secrezione tubulare, la co-somministrazione di farmaci che usano lo stesso sistema cationico renale, incluso l'idroclorotiazide (HCTZ), il triamterene (TA), la metformina, la cimetidina, la ranitidina, la chinidina e la nicotina, potrebbero potenzialmente determinare livelli plasmatici alterati di entrambi gli agenti. Tuttavia, la somministrazione concomitante di Namenda e HCTZ / TA non ha influenzato la biodisponibilità di memantina o TA e la biodisponibilità di HCTZ è diminuita del 20%. Inoltre, la somministrazione concomitante di memantina con il farmaco anti-iperglicemico Glucovance® (gliburide e metformina HCl) non ha influito sulla farmacocinetica di memantina, metformina e gliburide. Inoltre, memantina non ha modificato l'effetto ipoglicemizzante di Glucovance®.
Farmaci che rendono le urine alcaline: La clearance della memantina è stata ridotta di circa l'80% in condizioni di urina alcalina a pH 8. Pertanto, alterazioni del pH delle urine verso la condizione alcalina possono portare ad un accumulo del farmaco con un possibile aumento degli effetti avversi. Il pH delle urine è alterato dalla dieta, dai farmaci (ad es. Inibitori dell'anidrasi carbonica, bicarbonato di sodio) e dallo stato clinico del paziente (ad es. Acidosi tubulare renale o gravi infezioni del tratto urinario). Quindi, memantina dovrebbe essere usata con cautela in queste condizioni.
Cancerogenesi, mutagenesi e alterazione della fertilità
Non sono stati evidenziati casi di cancerogenicità in uno studio orale di 113 settimane su topi a dosi fino a 40 mg / kg / die (10 volte la dose massima raccomandata nell'uomo [MRHD] su base mg / m 2). Non sono stati inoltre evidenziati casi di cancerogenicità nei ratti trattati per via orale fino a 40 mg / kg / die per 71 settimane seguito da 20 mg / kg / die (20 e 10 volte l'MRHD su una base mg / m 2, rispettivamente) per 128 settimane.
Memantina non ha prodotto prove di potenziale genotossico quando valutata in vitro S. typhimurium o E. test di mutazione inversa coli, test di aberrazione cromosomica in vitro nei linfociti umani, test di citogenetica in vivo per danni ai cromosomi nei ratti e test di micronucleo di topo in vivo. I risultati sono stati equivoci in un test di mutazione genetica in vitro utilizzando cellule V79 di criceto cinese.
Non è stata osservata alcuna alterazione della fertilità o delle prestazioni riproduttive nei ratti somministrati fino a 18 mg / kg / die (9 volte la MRHD in mg / m 2 base) per via orale da 14 giorni prima dell'accoppiamento attraverso la gestazione e l'allattamento nelle femmine, o per 60 giorni prima dell'accoppiamento in maschi.
Gravidanza
Categoria di gravidanza B: Memantina somministrata per via orale a ratti gravidi e conigli gravidi durante il periodo di organogenesi non è stata teratogena fino alle dosi più elevate testate (18 mg / kg / die nei ratti e 30 mg / kg / die nei conigli, che sono rispettivamente 9 e 30 volte la dose massima raccomandata nell'uomo [MRHD] su un mg / m 2 base).
Sono state osservate una lieve tossicità materna, una riduzione del peso dei cuccioli e una maggiore incidenza di vertebre cervicali non ossificate dose di 18 mg / kg / die in uno studio in cui ai ratti è stata somministrata memantina orale iniziando il pre-accoppiamento e proseguendo attraverso il postpartum periodo. Una leggera tossicità materna e una riduzione del peso dei cuccioli sono state osservate a questa dose in uno studio in cui i ratti sono stati trattati dal 15 ° giorno di gestazione durante il periodo post-partum. La dose senza effetti per questi effetti era di 6 mg / kg, che è 3 volte la MRHD su una base di mg / m 2.
Non esistono studi adeguati e ben controllati sulla memantina in donne in gravidanza. Memantina deve essere usata durante la gravidanza solo se il potenziale beneficio giustifica il potenziale rischio per il feto.
Madri che allattano
Non è noto se la memantina sia escreta nel latte materno umano. Poiché molti farmaci vengono escreti nel latte materno, è necessario prestare attenzione quando la memantina viene somministrata a una madre che allatta.
Uso pediatrico
Non esistono studi adeguati e ben controllati che documentino la sicurezza e l'efficacia della memantina in tutte le malattie che si verificano nei bambini.
Reazioni avverse
L'esperienza descritta in questa sezione deriva da studi condotti su pazienti con malattia di Alzheimer e demenza vascolare.
Eventi avversi che portano alla sospensione: Negli studi controllati verso placebo in cui i pazienti affetti da demenza hanno ricevuto dosi di Namenda fino a 20 mg / die, il la probabilità di interruzione a causa di un evento avverso era la stessa nel gruppo Namenda come nel placebo gruppo. Nessun singolo evento avverso è stato associato con l'interruzione del trattamento nell'1% o più dei pazienti trattati con Namenda e ad un tasso superiore al placebo.
Eventi avversi segnalati in prove controllate: Gli eventi avversi riportati negli studi di Namenda (memantina cloridrato) riflettono l'esperienza acquisita in condizioni attentamente monitorate in una popolazione di pazienti altamente selezionata. Nella pratica reale o in altri studi clinici, queste stime di frequenza potrebbero non essere applicabili, poiché le condizioni d'uso, il comportamento di segnalazione e i tipi di pazienti trattati possono differire. La Tabella 1 elenca i segni e i sintomi emergenti dal trattamento che sono stati riportati in almeno il 2% dei pazienti controllati con placebo studi sulla demenza e per i quali il tasso di insorgenza era maggiore nei pazienti trattati con Namenda rispetto a quelli trattati placebo. Nessun evento avverso si è verificato con una frequenza di almeno il 5% e il doppio della percentuale di placebo.
Sistema del corpo |
Placebo (N = 922) % |
Namenda (N = 940) % |
Il corpo come un tutto | ||
Fatica |
1 | 2 |
Dolore |
1 | 3 |
Sistema cardiovascolare | ||
Ipertensione |
2 | 4 |
Sistema nervoso centrale e periferico | ||
Vertigini |
5 | 7 |
Mal di testa |
3 | 6 |
Sistema gastrointestinale | ||
Stipsi |
3 | 5 |
vomito |
2 | 3 |
Sistema muscoloscheletrico | ||
Mal di schiena |
2 | 3 |
Disturbi psichiatrici | ||
Confusione |
5 | 6 |
Sonnolenza |
2 | 3 |
Allucinazione |
2 | 3 |
Sistema respiratorio | ||
tosse |
3 | 4 |
Dispnea |
1 | 2 |
Altri eventi avversi che si verificano con un'incidenza di almeno il 2% nei pazienti trattati con Namenda ma a un tasso maggiore o uguale sul placebo sono stati agitazione, caduta, lesioni inflitte, incontinenza urinaria, diarrea, bronchite, insonnia, infezione del tratto urinario, sintomi simil-influenzali, andatura anormale, depressione, infezione del tratto respiratorio superiore, ansia, edema periferico, nausea, anoressia e artralgia.
Il profilo generale degli eventi avversi e i tassi di incidenza dei singoli eventi avversi nella sottopopolazione di pazienti con la malattia di Alzheimer da moderata a grave non differiva dal profilo e dai tassi di incidenza sopra descritti per la demenza generale popolazione.
Cambiamenti vitali: I gruppi di Namenda e placebo sono stati confrontati rispetto a (1) variazione media rispetto al basale nei segni vitali (polso, pressione sistolica, sangue diastolico pressione e peso) e (2) l'incidenza dei pazienti che soddisfano i criteri per cambiamenti potenzialmente clinicamente significativi rispetto al basale in questi variabili. Non ci sono stati cambiamenti clinicamente importanti nei segni vitali nei pazienti trattati con Namenda. Un confronto tra le misure supine e permanenti di segni vitali per Namenda e placebo in soggetti normali anziani ha indicato che il trattamento con Namenda non è associato a cambiamenti ortostatici.
Modifiche di laboratorio: I gruppi di Namenda e placebo sono stati confrontati rispetto a (1) variazione media rispetto al basale in varie sostanze chimiche sieriche, ematologia e variabili delle analisi delle urine e (2) l'incidenza dei pazienti che soddisfano i criteri per cambiamenti potenzialmente clinicamente significativi rispetto al basale in questi variabili. Queste analisi non hanno rivelato cambiamenti clinicamente importanti nei parametri dei test di laboratorio associati al trattamento con Namenda.
Modifiche ECG: I gruppi Namenda e placebo sono stati confrontati rispetto a (1) variazione media rispetto al basale in vari parametri ECG e (2) l'incidenza di pazienti che soddisfano i criteri per cambiamenti potenzialmente clinicamente significativi rispetto al basale in questi variabili. Queste analisi non hanno rivelato cambiamenti clinicamente importanti nei parametri ECG associati al trattamento con Namenda.
Altri eventi avversi osservati durante le prove cliniche
Namenda è stato somministrato a circa 1350 pazienti con demenza, di cui oltre 1200 hanno ricevuto la dose massima raccomandata di 20 mg / die. I pazienti hanno ricevuto il trattamento Namenda per periodi fino a 884 giorni, con 862 pazienti che hanno ricevuto almeno 24 settimane di trattamento e 387 pazienti che hanno ricevuto 48 settimane o più di trattamento.
Segni e sintomi emergenti dal trattamento verificatisi durante 8 studi clinici controllati e 4 in aperto le sperimentazioni sono state registrate come eventi avversi dagli investigatori clinici usando la propria terminologia la scelta. Per fornire una stima complessiva della percentuale di individui con tipi di eventi simili, gli eventi sono stati raggruppati in un numero inferiore di categorie standardizzate usando la terminologia dell'OMS e le frequenze degli eventi sono state calcolate su tutti studi.
Sono inclusi tutti gli eventi avversi che si verificano in almeno due pazienti, ad eccezione di quelli già elencati nella Tabella 1, anche i termini dell'OMS generale per essere informativo, sintomi minori o eventi che difficilmente possono essere causati da farmaci, ad esempio perché sono comuni nello studio popolazione. Gli eventi sono classificati in base al sistema corporeo ed elencati usando le seguenti definizioni: eventi avversi frequenti - quelli che si verificano in almeno 1/100 pazienti; eventi avversi rari - quelli che si verificano in pazienti da 1/100 a 1/1000. Questi eventi avversi non sono necessariamente correlati al trattamento con Namenda e nella maggior parte dei casi sono stati osservati con una frequenza simile nei pazienti trattati con placebo negli studi controllati.
Il corpo come un tutto: Frequente: sincope. Raro: ipotermia, reazione allergica.
Sistema cardiovascolare: Frequente: insufficienza cardiaca. Raro: angina pectoris, bradicardia, infarto del miocardio, tromboflebite, fibrillazione atriale, ipotensione, arresto cardiaco, ipotensione posturale, embolia polmonare, edema polmonare.
Sistema nervoso centrale e periferico: Frequente: attacco ischemico transitorio, accidente cerebrovascolare, vertigini, atassia, ipocinesia. Raro: parestesia, convulsioni, disturbo extrapiramidale, ipertonia, tremore, afasia, ipoestesia, anormale coordinazione, emiplegia, ipercinesia, contrazioni muscolari involontarie, stupore, emorragia cerebrale, nevralgia, ptosi, neuropatia.
Sistema gastrointestinale: Raro: gastroenterite, diverticolite, emorragia gastrointestinale, melena, ulcerazione esofagea.
Disturbi emici e linfatici: Frequente: anemia. Raro: leucopenia.
Disturbi metabolici e nutrizionali: Frequente: aumento dell'alcalina e fosfatasi, riduzione del peso. Raro: disidratazione, iponatriemia, diabete mellito aggravato.
Disturbi psichiatrici: Frequente: reazione aggressiva. Raro: delirio, disturbo della personalità, labilità emotiva, nervosismo, disturbo del sonno, aumento della libido, psicosi, amnesia, apatia, reazione paranoica, pensiero anormale, pianto anormale, aumento dell'appetito, paroniria, delirio, depersonalizzazione, nevrosi, suicidio tentativo.
Sistema respiratorio: Frequente: polmonite. Raro: apnea, asma, emottisi.
Pelle e appendici: Frequente: eruzione cutanea. Raro: ulcerazione cutanea, prurito, cellulite, eczema, dermatite, eruzione cutanea eritematosa, alopecia, orticaria.
Sensi speciali: Frequente: cataratta, congiuntivite. Raro: degenerazione della macula lutea, diminuzione dell'acuità visiva, diminuzione dell'udito, acufene, blefarite, visione offuscata, opacità corneale, glaucoma, emorragia congiuntivale, dolore agli occhi, emorragia retinica, xeroftalmia, diplopia, lacrimazione anormale, miopia, distacco della retina.
Sistema urinario: Frequente: frequente minzione. Raro: disuria, ematuria, ritenzione urinaria.
Eventi segnalati in seguito alla commercializzazione di Namenda, sia statunitensi che statunitensi
Sebbene non sia stata trovata alcuna relazione causale con il trattamento con memantina, sono stati riportati i seguenti eventi avversi associati temporalmente con il trattamento con memantina e descritto altrove nell'etichettatura: blocco atrioventricolare, frattura ossea, sindrome del tunnel carpale, infarto cerebrale, dolore toracico, claudicazione, colite, discinesia, disfagia, gastrite, reflusso gastroesofageo, convulsioni del grande male, emorragia intracranica, insufficienza epatica, iperlipidemia, ipoglicemia, ileo, impotenza, malessere, sindrome neurolettica maligna, acuta pancreatite, polmonite da aspirazione, insufficienza renale acuta, intervallo QT prolungato, irrequietezza, sindrome di Stevens-Johnson, morte improvvisa, tachicardia sopraventricolare, tachicardia, tardivo discinesia e trombocitopenia.
TOSSICOLOGIA ANIMALE
Le lesioni neuronali indotte dalla memantina (vacuolazione e necrosi) nelle cellule multipolari e piramidali negli strati corticali III e IV del posteriore neocortici cingolati e retrospleniali nei ratti, simili a quelli che si verificano nei roditori somministrati ad altri antagonisti del recettore NMDA. Le lesioni sono state osservate dopo una singola dose di memantina. In uno studio in cui ai ratti sono state somministrate dosi orali giornaliere di memantina per 14 giorni, la dose senza effetti per la necrosi neuronale era 6 volte la dose massima raccomandata nell'uomo su base mg / m 2. Il potenziale di induzione della vacuolazione neuronale centrale e della necrosi da parte degli antagonisti del recettore NMDA nell'uomo non è noto.
ABUSO E DIPENDENZA DROGA
Classe di sostanza controllata: Memantina HCl non è una sostanza controllata.
Dipendenza fisica e psicologica: Memantine HCl è un antagonista NMDA non competitivo di affinità da bassa a moderata che non ha prodotto alcuna prova di ricerca di droga sintomi comportamentali o di astinenza all'interruzione di 2.504 pazienti che hanno partecipato a studi clinici a livello terapeutico dosi. I dati post-marketing, al di fuori degli Stati Uniti, raccolti in modo retrospettivo, non hanno fornito prove di abuso o dipendenza da droghe.
Overdose
Poiché le strategie per la gestione del sovradosaggio sono in continua evoluzione, è consigliabile contattare a centro antiveleni per determinare le ultime raccomandazioni per la gestione di una dose eccessiva di qualsiasi droga.
Come in tutti i casi di sovradosaggio, devono essere utilizzate misure di supporto generali e il trattamento deve essere sintomatico. L'eliminazione della memantina può essere migliorata dall'acidificazione delle urine. In un caso documentato di sovradosaggio con fino a 400 mg di memantina, il paziente ha manifestato irrequietezza, psicosi, allucinazioni visive, sonnolenza, stupore e perdita di coscienza. Il paziente si riprese senza sequele permanenti.
Dosaggio e amministrazione
Il dosaggio di Namenda (memantina cloridrato) dimostrato di essere efficace negli studi clinici controllati è di 20 mg / die.
La dose iniziale raccomandata di Namenda è di 5 mg una volta al giorno. La dose target raccomandata è di 20 mg / die. La dose deve essere aumentata con incrementi di 5 mg a 10 mg / giorno (5 mg due volte al giorno), 15 mg / giorno (5 mg e 10 mg come dosi separate) e 20 mg / giorno (10 mg due volte al giorno). L'intervallo minimo raccomandato tra gli aumenti di dose è di una settimana.
Namenda può essere assunto con o senza cibo.
I pazienti / i caregiver devono essere istruiti su come utilizzare il dispositivo di dosaggio della soluzione orale Namenda. Devono essere informati del foglio di istruzioni per il paziente allegato al prodotto. I pazienti / caregiver devono essere istruiti a rispondere a qualsiasi domanda sull'uso della soluzione al proprio medico o farmacista.
Dosi in popolazioni speciali
Si raccomanda una dose target di 5 mg BID nei pazienti con grave insufficienza renale (clearance della creatinina di 5 - 29 ml / min in base all'equazione di Cockroft-Gault):
Per i maschi: CLcr = [140 anni (anni)] · Peso (kg) / [72 · creatinina sierica (mg / dL)]
Per le femmine: CLcr = 0,85 · [140 anni (anni)] · Peso (kg) / [72 · creatinina sierica (mg / dL)]
Come fornito
Compressa da 5 mg:
Bottiglia da 60 NDC # 0456-3205-60
10 ø 10 unità Dose NDC # 0456-3205-63
Le compresse a forma di capsula, rivestite con film, sono abbronzate, con la forza (5) impressa su un lato e FL sull'altro.
Compressa da 10 mg:
Bottiglia da 60 NDC # 0456-3210-60
10 ø 10 unità Dose NDC # 0456-3210-63
Le compresse a forma di capsula, rivestite con film, sono grigie, con la forza (10) impressa su un lato e FL sull'altro.
Pak titolazione:
Blister in PVC / alluminio contenente 49 compresse. 28 compresse da 5 mg e 21 compresse da 10 mg. NDC # 0456-3200-14
Le compresse rivestite con film a forma di capsula da 5 mg sono marrone chiaro, con la forza (5) impressa su un lato e FL sull'altro. Le compresse rivestite con film a forma di capsula da 10 mg sono grigie, con la forza (10) impressa su un lato e FL sull'altro.
Soluzione orale:
Le raccomandazioni posologiche per la soluzione orale sono le stesse di quelle per compresse. La soluzione orale è limpida, senza alcool, senza zucchero e con aroma di menta piperita.
2 mg / ml soluzione orale (10 mg = 5 mL)
12 fl. once. (360 ml) flacone NDC # 0456-3202-12
Conservare a 25 ° C (77 ° F); escursioni consentite a 15-30 ° C (59-86 ° F) [vedi temperatura ambiente controllata USP].
Forest Pharmaceuticals, Inc.
Filiale di Forest Laboratories, Inc.
St. Louis, MO 63045
Concesso in licenza da Merz Pharmaceuticals GmbH
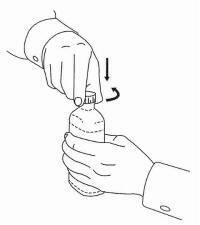
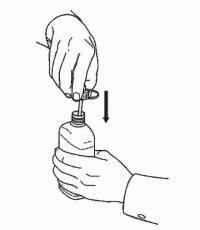
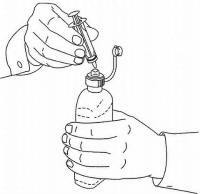
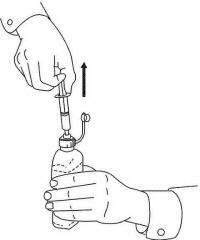
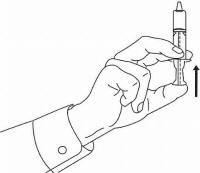
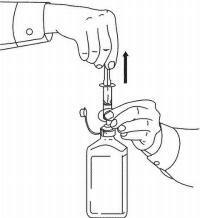
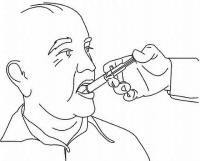
ISTRUZIONI PER IL PAZIENTE PER NAMENDA® Oral Solution
Seguire le istruzioni seguenti per utilizzare il dispositivo di dosaggio della soluzione orale Namenda®.
IMPORTANTE: leggere queste istruzioni prima di utilizzare la soluzione orale Namenda®.
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
IMPORTANTE: Le informazioni contenute in questa monografia non intendono coprire tutti i possibili usi, indicazioni, precauzioni, interazioni farmacologiche o effetti avversi. Questa informazione è generalizzata e non è intesa come consulenza medica specifica. Se ha domande sui medicinali che sta assumendo o desidera maggiori informazioni, consultare il medico, il farmacista o l'infermiere. Ultimo aggiornamento 4/07.
Fonte: Forest Laboratories, distributore statunitense di Namenda.
Namenda Informazioni paziente (in semplice inglese)
torna a: Homepage di farmacologia dei farmaci psichiatrici



