Avandia per il trattamento del diabete
Marchio: AVANDIA
Nome generico: rosiglitazone maleato
Contenuti:
Indicazioni e utilizzo
Dosaggio e amministrazione
Forme di dosaggio e punti di forza
Controindicazioni
Avvertenze e precauzioni
Reazioni avverse
Interazioni farmacologiche
Utilizzare in popolazioni specifiche
sovradosaggio
Descrizione
Farmacologia clinica
Tossicologia non clinica
Studi clinici
Come fornito
Avandia, rosiglitazone maleato, informazioni per il paziente (in inglese semplice)
AVVERTIMENTO
MALE CONGESTIVO E ISCHEMIA MIOCARDICA
- I tiazolidinedioni, incluso il rosiglitazone, causano o esacerbano l'insufficienza cardiaca congestizia in alcuni pazienti [vedi AVVERTENZE E PRECAUZIONI]. Dopo l'inizio di AVANDIA e dopo l'aumento della dose, osservare attentamente i pazienti per segni e sintomi di insufficienza cardiaca (incluso aumento di peso eccessivo, rapido, dispnea e / o edema). Se si sviluppano questi segni e sintomi, l'insufficienza cardiaca deve essere gestita secondo gli attuali standard di cura. Inoltre, si deve considerare l'interruzione o la riduzione della dose di AVANDIA.
- AVANDIA non è raccomandato nei pazienti con insufficienza cardiaca sintomatica. L'inizio di AVANDIA nei pazienti con insufficienza cardiaca di classe NYHA III o IV stabilita è controindicato. [Vedere CONTROINDICAZIONI e AVVERTENZE E PRECAUZIONI.]
- Una meta-analisi di 42 studi clinici (durata media 6 mesi; 14.237 pazienti totali), la maggior parte dei quali ha confrontato AVANDIA con placebo, ha mostrato che AVANDIA è associato ad un aumentato rischio di eventi ischemici del miocardio come angina o infarto del miocardio. Altri tre studi (durata media 41 mesi; 14.067 pazienti totali), confrontando AVANDIA con altri agenti antidiabetici orali approvati o placebo, non hanno confermato o escluso questo rischio. Nella loro interezza, i dati disponibili sul rischio di ischemia miocardica sono inconcludenti. [Vedere AVVERTENZE E PRECAUZIONI.]
superiore
Indicazioni e utilizzo
Monoterapia e terapia combinata
AVANDIA è indicato in aggiunta alla dieta e all'esercizio fisico per migliorare il controllo glicemico negli adulti con diabete mellito di tipo 2.
Limitazioni d'uso importanti
- A causa del suo meccanismo d'azione, AVANDIA è attivo solo in presenza di insulina endogena. Pertanto, AVANDIA non deve essere usato in pazienti con diabete mellito di tipo 1 o per il trattamento della chetoacidosi diabetica.
- La somministrazione concomitante di AVANDIA e insulina non è raccomandata.
- L'uso di AVANDIA con nitrati non è raccomandato.
superiore
Dosaggio e amministrazione
La gestione della terapia antidiabetica deve essere personalizzata. Tutti i pazienti devono iniziare AVANDIA alla dose minima raccomandata. Ulteriori aumenti della dose di AVANDIA devono essere accompagnati da un attento monitoraggio degli eventi avversi correlati alla ritenzione di liquidi [vedere Avviso in scatola e AVVERTENZE e PRECAUZIONI].
AVANDIA può essere somministrato a una dose iniziale di 4 mg in singola dose giornaliera o in 2 dosi divise. Per i pazienti che rispondono inadeguatamente dopo 8-12 settimane di trattamento, come determinato dalla riduzione della glicemia a digiuno (FPG), la dose può essere aumentata a 8 mg al giorno in monoterapia o in combinazione con metformina, sulfonilurea o sulfonilurea plus metformina. Le riduzioni dei parametri glicemici per dose e regime sono descritte in Studi clinici. AVANDIA può essere assunto con o senza cibo.
La dose giornaliera totale di AVANDIA non deve superare gli 8 mg.
monoterapia
La dose iniziale abituale di AVANDIA è di 4 mg somministrati in dose singola una volta al giorno o in dosi divise due volte al giorno. Negli studi clinici, il regime da 4 mg due volte al giorno ha portato alla massima riduzione dell'FPG e dell'emoglobina A1c (HbA1c).
Combinazione con solfonilurea o metformina
Quando AVANDIA viene aggiunto alla terapia esistente, la dose o le dosi correnti dell'agente (i) possono essere continuate all'inizio della terapia con AVANDIA.
sulfonilurea: Se usato in associazione con sulfonilurea, la dose iniziale abituale di AVANDIA è di 4 mg somministrata in dose singola una volta al giorno o in dosi divise due volte al giorno. Se i pazienti riportano ipoglicemia, la dose della sulfonilurea deve essere ridotta.
Metformina: La dose iniziale abituale di AVANDIA in combinazione con metformina è di 4 mg somministrata in dose singola una volta al giorno o in dosi divise due volte al giorno. È improbabile che la dose di metformina richieda un aggiustamento a causa dell'ipoglicemia durante la terapia di associazione con AVANDIA.
Combinazione con solfonilurea Plus metformina
La dose iniziale abituale di AVANDIA in combinazione con una sulfonilurea più metformina è di 4 mg somministrata in dose singola una volta al giorno o suddivisa in due volte al giorno. Se i pazienti riportano ipoglicemia, la dose della sulfonilurea deve essere ridotta.
Popolazioni specifiche di pazienti
Insufficienza renale: Non è necessario alcun aggiustamento del dosaggio quando AVANDIA è usato in monoterapia in pazienti con insufficienza renale. Poiché la metformina è controindicata in tali pazienti, la somministrazione concomitante di metformina e AVANDIA è anche controindicata nei pazienti con insufficienza renale.
Insufficienza epatica: Gli enzimi epatici devono essere misurati prima di iniziare il trattamento con AVANDIA. La terapia con AVANDIA non deve essere iniziata se il paziente presenta evidenza clinica di attività attiva malattia epatica o aumento dei livelli sierici di transaminasi (ALT> 2,5 volte il limite superiore del normale all'inizio del terapia). Dopo l'inizio di AVANDIA, gli enzimi epatici devono essere monitorati periodicamente secondo il giudizio clinico del personale sanitario. [Vedere AVVERTENZE e PRECAUZIONI e FARMACOLOGIA CLINICA.]
pediatrica: I dati non sono sufficienti per raccomandare l'uso pediatrico di AVANDIA [vedere UTILIZZO in POPOLAZIONI SPECIFICHE].
superiore
Forme di dosaggio e punti di forza
La compressa pentagonale di TILTAB rivestita con film contiene rosiglitazone come maleato come segue:
- 2 mg - rosa, inciso con SB su un lato e 2 sull'altro
- 4 mg - arancione, impresso con SB da un lato e 4 dall'altro
- 8 mg - rosso-marrone, impresso con SB da un lato e 8 dall'altro
superiore
Controindicazioni
L'inizio di AVANDIA nei pazienti con insufficienza cardiaca di classe III o IV stabilita dalla New York Heart Association (NYHA) è controindicato [vedere AVVERTENZA CONFEZIONATA].
superiore
Avvertenze e precauzioni
Insufficienza cardiaca
AVANDIA, come altri tiazolidinedioni, da soli o in combinazione con altri agenti antidiabetici, può causare ritenzione di liquidi, che può esacerbare o portare a insufficienza cardiaca. I pazienti devono essere osservati per segni e sintomi di insufficienza cardiaca. Se si sviluppano questi segni e sintomi, l'insufficienza cardiaca deve essere gestita secondo gli attuali standard di cura. Inoltre, si deve considerare l'interruzione o la riduzione della dose di rosiglitazone [vedi AVVERTENZA CONFEZIONATA].
Pazienti con insufficienza cardiaca congestizia (CHF) Le classi NYHA di classe I e II trattate con AVANDIA hanno un aumentato rischio di eventi cardiovascolari. Uno studio ecocardiografico di 52 settimane, in doppio cieco, controllato con placebo, è stato condotto su 224 pazienti con tipo 2 diabete mellito e NYHA Classe I o II CHF (frazione di eiezione â € ¤ 45%) su antidiabetico di base e CHF terapia. Un comitato indipendente ha condotto una valutazione in cieco di eventi relativi ai fluidi (incluso insufficienza cardiaca congestizia) e ricoveri cardiovascolari secondo criteri predefiniti (aggiudicazione). Separatamente dalla sentenza, gli investigatori hanno riportato altri eventi avversi cardiovascolari. Sebbene non sia stata osservata alcuna differenza di trattamento nel cambiamento rispetto al basale delle frazioni di eiezione, di più eventi avversi cardiovascolari sono stati osservati dopo il trattamento con AVANDIA rispetto al placebo durante il Studio di 52 settimane. (Vedi tabella 1.)
Tabella 1. Eventi avversi cardiovascolari emergenti in pazienti con insufficienza cardiaca congestizia (classe NYHA I e II) trattati con AVANDIA o placebo (in aggiunta alla terapia antidiabetica di base e terapia CHF)
| eventi | AVANDIA N = 110 n (%) |
Placebo N = 114 n (%) |
| sentenziato | ||
| Morti cardiovascolari | 5 (5%) | 4 (4%) |
| Peggioramento del CHF | 7 (6%) | 4 (4%) |
| - con ricovero notturno | 5 (5%) | 4 (4%) |
| - senza ricovero notturno | 2 (2%) | 0 (0%) |
| Edema nuovo o in peggioramento | 28 (25%) | 10 (9%) |
| Dispnea nuova o in peggioramento | 29 (26%) | 19 (17%) |
| Aumenti dei farmaci in CHF | 36 (33%) | 20 (18%) |
| Ricovero cardiovascolare * | 21 (19%) | 15 (13%) |
| Riferito dallo sperimentatore, non giudicato | ||
| Eventi avversi ischemici | 10 (9%) | 5 (4%) |
| - Infarto miocardico | 5 (5%) | 2 (2%) |
| - Angina | 6 (5%) | 3 (3%) |
| * Include il ricovero per qualsiasi motivo cardiovascolare. |
L'inizio di AVANDIA nei pazienti con insufficienza cardiaca di classe NYHA III o IV stabilita è controindicato. AVANDIA non è raccomandato nei pazienti con insufficienza cardiaca sintomatica. [Vedere AVVERTENZA CONFEZIONATA.]
I pazienti con sindromi coronariche acute non sono stati studiati in studi clinici controllati. In considerazione del potenziale sviluppo di insufficienza cardiaca in pazienti con un evento coronarico acuto, l'inizio di AVANDIA non lo è raccomandato per i pazienti che manifestano un evento coronarico acuto e l'interruzione di AVANDIA durante questa fase acuta dovrebbe essere considerato.
I pazienti con stato cardiaco NYHA Classe III e IV (con o senza CHF) non sono stati studiati in studi clinici controllati. AVANDIA non è raccomandato nei pazienti con stato cardiaco di classe III e IV NYHA.
Ischemia miocardica
Meta-analisi dell'ischemia miocardica in un gruppo di 42 studi clinici
Una meta-analisi è stata condotta retrospettivamente per valutare gli eventi avversi cardiovascolari riportati in 42 studi clinici in doppio cieco, randomizzati e controllati (durata media 6 mesi).1
Questi studi erano stati condotti per valutare l'efficacia ipoglicemizzante nel diabete di tipo 2 e negli studi non si erano verificati casi giudiziari prospettici di eventi cardiovascolari. Alcuni studi sono stati controllati con placebo e alcuni hanno utilizzato farmaci antidiabetici orali attivi come controlli. Gli studi controllati con placebo hanno incluso studi in monoterapia (monoterapia con AVANDIA contro placebo in monoterapia) e studi aggiuntivi (AVANDIA o placebo, aggiunti a sulfonilurea, metformina o insulina). Gli studi di controllo attivo includevano studi in monoterapia (monoterapia con AVANDIA contro sulfonilurea o metformina monoterapia) e studi aggiuntivi (AVANDIA più sulfonilurea o AVANDIA più metformina, contro sulfonilurea più metformina). Sono stati inclusi in totale 14.237 pazienti (8.604 in gruppi di trattamento contenenti AVANDIA, 5.633 pollici gruppi di confronto), con 4.143 anni-paziente di esposizione ad AVANDIA e 2.675 anni-paziente di esposizione a comparatore. Gli eventi ischemici del miocardio includevano angina pectoris, angina pectoris aggravata, angina instabile, arresto cardiaco, dolore toracico, coronarica occlusione dell'arteria, dispnea, infarto del miocardio, trombosi coronarica, ischemia miocardica, malattia coronarica e arteria coronarica disturbo. In questa analisi, un aumentato rischio di ischemia miocardica con AVANDIA rispetto a comparatori combinati è stato osservato (AVANDIA al 2% rispetto a comparatori dell'1,5%, odds ratio 1,4, intervallo di confidenza al 95% [CI] 1,1, 1.8). Un aumento del rischio di eventi ischemici del miocardio con AVANDIA è stato osservato negli studi controllati verso placebo, ma non negli studi controllati attivi. (Vedi figura 1)
Un maggiore aumento del rischio di eventi ischemici del miocardio è stato osservato negli studi in cui è stato aggiunto AVANDIA all'insulina (2,8% per AVANDIA più insulina contro 1,4% per placebo più insulina, [OR 2.1, IC 95% 0,9, 5.1]). Questo aumento del rischio riflette una differenza di 3 eventi per 100 pazienti-anno (IC 95% -0,1, 6,3) tra i gruppi di trattamento. [Vedere AVVERTENZE E PRECAUZIONI.]
Figura 1. Rapporti del diagramma delle quote della foresta (intervalli di confidenza al 95%) per eventi ischemici del miocardio nella meta-analisi di 42 studi clinici
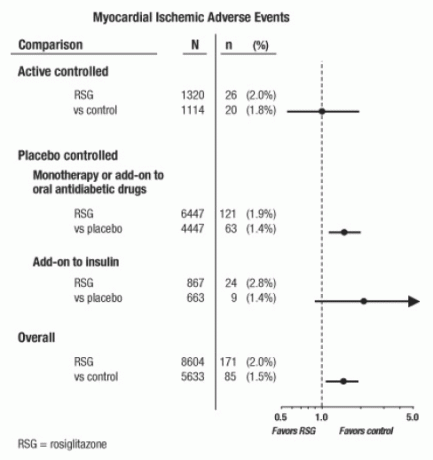
Un maggiore aumento del rischio di ischemia miocardica è stato osservato anche in pazienti che hanno ricevuto AVANDIA e terapia con nitrati di fondo. Per AVANDIA (N = 361) rispetto al controllo (N = 244) negli utenti di nitrati, il rapporto di probabilità era 2,9 (IC 95% 1,4, 5.9), mentre per gli utenti non nitrati (circa 14.000 pazienti in totale), il rapporto di probabilità era 1,3 (IC 95% 0,9, 1.7). Questo aumento del rischio rappresenta una differenza di 12 eventi ischemici del miocardio per 100 pazienti-anno (IC 95% 3,3, 21,4). La maggior parte dei consumatori di nitrati aveva stabilito una malattia coronarica. Tra i pazienti con malattia coronarica nota che non erano in terapia con nitrati, non è stato dimostrato un aumento del rischio di eventi ischemici del miocardio per AVANDIA rispetto al comparatore.
Eventi ischemici del miocardio in grandi trial controllati randomizzati prospettici a lungo termine di AVANDIA
I dati di altri 3 studi clinici di grandi dimensioni, a lungo termine, prospettici, randomizzati e controllati su AVANDIA sono stati valutati separatamente dalla meta-analisi. Questi 3 studi comprendono un totale di 14.067 pazienti (gruppi di trattamento contenenti AVANDIA N = 6.311, comparatore gruppi N = 7.756), con un'esposizione per anno-paziente di 21.803 anni-paziente per AVANDIA e 25.998 anni-paziente per comparatore. La durata del follow-up ha superato i 3 anni in ogni studio. ADOPT (A Diabetes Outcomes Progression Trial) è stato uno studio randomizzato, controllato in modo attivo, da 4 a 6 anni, in pazienti con diagnosi recente di diabete di tipo 2 naïve alla terapia farmacologica.
È stata una prova di efficacia e sicurezza generale progettata per esaminare la durata di
AVANDIA come monoterapia (N = 1.456) per il controllo glicemico nel diabete di tipo 2, con bracci comparatori di sulfonilurea in monoterapia (N = 1.441) e metformina in monoterapia (N = 1.454). DREAM (Valutazione della riduzione del diabete con Rosiglitazone e Ramipril Medication, rapporto pubblicato2) era un 3- Studio randomizzato di 5 anni, controllato con placebo, su pazienti con ridotta tolleranza al glucosio e / o digiuno compromesso glucosio. Aveva un disegno fattoriale 2x2, destinato a valutare l'effetto di AVANDIA e separatamente di ramipril (un inibitore dell'enzima di conversione dell'angiotensina [ACEI]), sulla progressione verso il diabete manifesto. In DREAM, 2.635 pazienti erano in gruppi di trattamento contenenti AVANDIA e 2.634 erano in gruppi di trattamento non contenenti I risultati intermedi di AVANDIA sono stati pubblicati 3 per RECORD (Rosiglitazone valutato per esiti cardiaci e regolazione della glicemia in Diabete), uno studio in aperto su 6 anni di esiti cardiovascolari in pazienti con diabete di tipo 2 con un trattamento medio durata di 3,75 anni. RECORD comprende pazienti che hanno fallito la monoterapia con metformina o sulfonilurea; coloro che hanno fallito la metformina sono randomizzati a ricevere il componente aggiuntivo AVANDIA o il componente aggiuntivo sulfonilurea, e quelli che hanno fallito la sulfonilurea sono randomizzati a ricevere il componente aggiuntivo AVANDIA o il componente aggiuntivo metformina. In RECORD, un totale di 2.220 pazienti stanno ricevendo un componente aggiuntivo AVANDIA e 2.227 pazienti sono sottoposti a uno dei regimi aggiuntivi che non contengono AVANDIA.
Per questi 3 studi, le analisi sono state eseguite utilizzando un composto di eventi cardiovascolari avversi maggiori (infarto del miocardio, morte cardiovascolare o ictus), di seguito denominato MACE. Questo endpoint differiva dall'ampio endpoint della meta-analisi degli eventi ischemici del miocardio, più della metà dei quali erano angina. L'infarto del miocardio includeva un infarto miocardico fatale e non fatale, più la morte improvvisa. Come mostrato nella Figura 2, i risultati per i 3 endpoint (MACE, MI e mortalità totale) non erano statisticamente significativamente diversi tra AVANDIA e i comparatori.
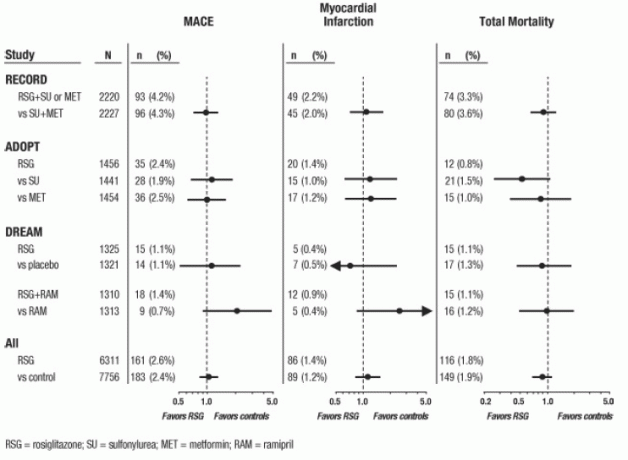
Nelle analisi preliminari dello studio DREAM, l'incidenza di eventi cardiovascolari era più elevata tra i soggetti che ha ricevuto AVANDIA in associazione con ramipril rispetto ai soggetti che hanno ricevuto ramipril da solo, come illustrato in Figura 2. Questa scoperta non è stata confermata in ADOPT e RECORD (studi controllati attivi su pazienti con diabete) in cui rispettivamente il 30% e il 40% dei pazienti ha riportato l'uso di ACE-inibitore al basale.
Nella loro interezza, i dati disponibili sul rischio di ischemia miocardica sono inconcludenti. Conclusioni definitive su questo rischio attendono il completamento di uno studio sugli esiti cardiovascolari adeguatamente progettato.
Non sono stati condotti studi clinici per stabilire prove conclusive della riduzione del rischio macrovascolare con AVANDIA o altri farmaci antidiabetici orali.
Insufficienza cardiaca congestizia e ischemia miocardica durante la co-somministrazione di AVANDIA con insulina
Negli studi in cui AVANDIA è stato aggiunto all'insulina, AVANDIA ha aumentato il rischio di insufficienza cardiaca congestizia e ischemia miocardica. (Vedi tabella 2.)
La somministrazione concomitante di AVANDIA e insulina non è raccomandata. [Vedere Indicazioni e utilizzo e AVVERTENZE E PRECAUZIONI.]
In cinque, 26 settimane, controllati, randomizzati, in doppio cieco, inclusi nella meta-analisi [vedi AVVERTENZE E PRECAUZIONI], i pazienti con diabete mellito di tipo 2 sono stati randomizzati alla somministrazione concomitante di AVANDIA e insulina (N = 867) o insulina (N = 663). In questi 5 studi, AVANDIA è stato aggiunto all'insulina. Questi studi includevano pazienti con diabete di lunga data (durata mediana di 12 anni) e un'alta prevalenza di preesistenti condizioni mediche, tra cui neuropatia periferica, retinopatia, cardiopatia ischemica, malattia vascolare e cuore congestionato fallimento. Il numero totale di pazienti con insufficienza cardiaca congestizia emergente era rispettivamente di 21 (2,4%) e 7 (1,1%) in AVANDIA più insulina e gruppi di insulina. Il numero totale di pazienti con ischemia miocardica emergente era 24 (2,8%) e 9 (1,4%) nei gruppi di insulina e insulina AVANDIA più rispettivamente (OR 2,1 [IC 95% 0,9, 5,1]). Sebbene il tasso di eventi per insufficienza cardiaca congestizia e ischemia miocardica fosse basso negli studi popolazione, costantemente il tasso di eventi era di 2 volte o superiore con la co-somministrazione di AVANDIA e insulina. Questi eventi cardiovascolari sono stati osservati alle dosi giornaliere di 4 e 8 mg di AVANDIA. (Vedi tabella 2.)
Tavolo 2. Presenza di eventi cardiovascolari in 5 studi controllati di aggiunta di AVANDIA al trattamento insulinico stabilito
| Evento* | AVANDIA + Insulina (n = 867) n (%) |
Insulina (n = 663) n (%) |
| Insufficienza cardiaca congestizia | 21 (2.4%) | 7 (1.1%) |
| Ischemia miocardica | 24 (2.8%) | 9 (1.4%) |
| Composito di morte cardiovascolare, infarto del miocardio o ictus | 10 (1.2%) | 5 (0.8%) |
| Ictus | 5 (0.6%) | 4 (0.6%) |
| Infarto miocardico | 4 (0.5%) | 1 (0.2%) |
| Morte cardiovascolare | 4 (0.5%) | 1 (0.2%) |
| Tutte le morti | 6 (0.7%) | 1 (0.2%) |
| * Gli eventi non sono esclusivi; cioè, un paziente con una morte cardiovascolare a causa di un infarto del miocardio verrebbe conteggiato in 4 categorie di eventi (ischemia miocardica; morte cardiovascolare, infarto del miocardio o ictus; infarto miocardico; morte cardiovascolare). |
In un sesto, 24 settimane, controllato, randomizzato, in doppio cieco di AVANDIA e co-somministrazione di insulina, l'insulina è stata aggiunta ad AVANDAMET® (rosiglitazone maleato e metformina HCl) (n = 161) e confrontato con insulina più placebo (n = 158), dopo un run-in di 8 settimane in cieco con AVANDAMET. I pazienti con edema che richiedono terapia farmacologica e quelli con insufficienza cardiaca congestizia sono stati esclusi al basale e durante il periodo di rodaggio.
Nel gruppo che ha ricevuto AVANDAMET più insulina, si è verificato un evento ischemico miocardico e una morte improvvisa. Non è stata osservata ischemia miocardica nel gruppo insulinico e non è stata segnalata insufficienza cardiaca congestizia in entrambi i gruppi di trattamento.
Edema
AVANDIA deve essere usato con cautela nei pazienti con edema. In uno studio clinico su volontari sani che hanno ricevuto 8 mg di AVANDIA una volta al giorno per 8 settimane, si è verificato un aumento statisticamente significativo del volume plasmatico mediano rispetto al placebo.
Poiché i tiazolidinedioni, incluso il rosiglitazone, possono causare ritenzione di liquidi, che può esacerbare o portare a insufficienza cardiaca congestizia, AVANDIA deve essere usato con cautela nei pazienti a rischio di cuore fallimento. I pazienti devono essere monitorati per segni e sintomi di insufficienza cardiaca [vedi AVVERTENZA CONFEZIONATA, AVVERTENZE E PRECAUZIONI ].
In studi clinici controllati su pazienti con diabete di tipo 2, è stato riportato edema da lieve a moderato in pazienti trattati con AVANDIA e può essere correlato alla dose. I pazienti con edema in corso avevano maggiori probabilità di avere eventi avversi associati all'edema se iniziato in terapia di associazione con insulina e AVANDIA [vedere REAZIONI AVVERSE].
Aumento di peso
L'aumento di peso correlato alla dose è stato osservato con AVANDIA da solo e in associazione con altri agenti ipoglicemizzanti (Tabella 3). Il meccanismo di aumento di peso non è chiaro ma probabilmente comporta una combinazione di ritenzione idrica e accumulo di grasso.
Nell'esperienza post-marketing, sono stati segnalati aumenti di peso insolitamente rapidi e aumenti superiori a quelli generalmente osservati negli studi clinici. I pazienti che manifestano tali aumenti devono essere valutati per l'accumulo di liquidi e gli eventi correlati al volume come edema eccessivo e insufficienza cardiaca congestizia [vedi AVVERTENZA CONFEZIONATA].
Tabella 3 Variazioni di peso (kg) dal basale all'endpoint durante le prove cliniche
| monoterapia | Durata | Gruppo di controllo | AVANDIA 4 mg Mediano (25 °, 75 ° percentile) |
AVANDIA 8 mg Mediano (25 °, 75 ° percentile) |
|
| Mediano (25 °, 75 ° percentile) | |||||
| 26 settimane | placebo | -0.9 (-2.8, 0.9) n = 210 |
1.0 (-0.9, 3.6) n = 436 |
3.1 (1.1, 5.8) n = 439 |
|
| 52 settimane | sulfonilurea | 2.0 (0, 4.0) n = 173 |
2.0 (-0.6, 4.0) n = 150 |
2.6 (0, 5.3) n = 157 |
|
| Terapia di combinazione | |||||
| sulfonilurea | 24-26 settimane | sulfonilurea | 0 (-1.0, 1.3) n = 1.155 |
2.2 (0.5, 4.0) n = 613 |
3.5 (1.4, 5.9) n = 841 |
| Metformina | 26 settimane | metformina | -1.4 (-3.2, 0.2) n = 175 |
0.8 (-1.0, 2.6) n = 100 |
2.1 (0, 4.3) n = 184 |
| Insulina | 26 settimane | insulina | 0.9 (-0.5, 2.7) n = 162 |
4.1 (1.4, 6.3) n = 164 |
5.4 (3.4, 7.3) n = 150 |
| Solfonilurea + metformina | 26 settimane | sulfonilurea + metformina | 0.2 (-1.2, 1.6) n = 272 |
2.5 (0.8, 4.6) n = 275 |
4.5 (2.4, 7.3) n = 276 |
In uno studio comparativo (ADOPT) di 4-6 anni, in pazienti con diagnosi recente di diabete di tipo 2 non precedentemente trattato con farmaci antidiabetici [vedere Studio clinicoS], la variazione di peso mediana (25esimo, 75esimo percentili) rispetto al basale a 4 anni era di 3,5 kg (0,0, 8,1) per AVANDIA, 2,0 kg (-1,0, 4,8) per gliburide e -2,4 kg (-5,4, 0,5) per la metformina.
In uno studio di 24 settimane su pazienti pediatrici di età compresa tra 10 e 17 anni trattati con AVANDIA da 4 a 8 mg al giorno, un aumento di peso mediano di 2,8 kg (25esimo, 75esimo percentili: 0,0, 5,8).
Effetti epatici
Gli enzimi epatici devono essere misurati prima dell'inizio della terapia con AVANDIA in tutti i pazienti e successivamente periodicamente secondo il giudizio clinico del personale sanitario. La terapia con AVANDIA non deve essere iniziata in pazienti con aumento dei livelli basali degli enzimi epatici (ALT> 2,5 volte il limite superiore del normale). Pazienti con enzimi epatici lievemente elevati (livelli di ALT - limite superiore di 2,5 volte il normale) al basale o durante la terapia con AVANDIA deve essere valutato per determinare la causa dell'enzima epatico elevazione. L'inizio o la continuazione della terapia con AVANDIA nei pazienti con lievi aumenti degli enzimi epatici deve procedere con cautela e includere uno stretto follow-up clinico, incluso il monitoraggio degli enzimi epatici, per determinare se gli aumenti degli enzimi epatici si risolvono o peggiorare. Se in qualsiasi momento i livelli di ALT aumentano a> 3 volte il limite superiore del normale nei pazienti in terapia con AVANDIA, i livelli degli enzimi epatici devono essere ricontrollati il più presto possibile. Se i livelli di ALT rimangono> 3 volte il limite superiore del normale, la terapia con AVANDIA deve essere interrotta.
Se un paziente sviluppa sintomi che suggeriscono disfunzione epatica, che può includere nausea inspiegabile, vomito, dolore addominale, affaticamento, anoressia e / o urine scure, è necessario controllare gli enzimi epatici. La decisione se continuare il paziente in terapia con AVANDIA deve essere guidata dal giudizio clinico in attesa di valutazioni di laboratorio. Se si osserva l'ittero, la terapia farmacologica deve essere interrotta. [Vedere REAZIONI AVVERSE.]
Edema maculare
L'edema maculare è stato riportato nell'esperienza post-marketing in alcuni pazienti diabetici che stavano assumendo AVANDIA o un altro tiazolidinedione. Alcuni pazienti presentavano visione offuscata o ridotta acuità visiva, ma alcuni pazienti sembrano essere stati diagnosticati con un esame oftalmologico di routine. La maggior parte dei pazienti presentava edema periferico al momento della diagnosi dell'edema maculare. Alcuni pazienti avevano un miglioramento del loro edema maculare dopo l'interruzione del loro tiazolidinedione. I pazienti con diabete dovrebbero sottoporsi a regolari esami della vista da parte di un oculista, secondo gli Standard di cura dell'American Diabetes Association. Inoltre, tutti i diabetici che segnalano qualsiasi tipo di sintomo visivo devono essere prontamente indirizzati a un oculista, indipendentemente dai farmaci sottostanti del paziente o da altri risultati fisici. [Vedere REAZIONI AVVERSE.]
fratture
In uno studio comparativo da 4 a 6 anni (ADOPT) sul controllo glicemico con monoterapia in pazienti mai trattati con farmaci recentemente con diagnosi di diabete mellito di tipo 2, è stata osservata una maggiore incidenza di fratture ossee nelle pazienti in terapia con donne Avandia. Nel periodo da 4 a 6 anni, l'incidenza della frattura ossea nelle femmine è stata del 9,3% (60/645) per AVANDIA contro il 3,5% (21/605) per glyburide e del 5,1% (30/590) per metformina. Questa maggiore incidenza è stata osservata dopo il primo anno di trattamento e persisteva nel corso dello studio. La maggior parte delle fratture nelle donne che hanno ricevuto AVANDIA si è verificata nella parte superiore del braccio, nella mano e nel piede. Questi siti di frattura sono diversi da quelli solitamente associati all'osteoporosi postmenopausale (ad es. Anca o colonna vertebrale). Non è stato osservato alcun aumento dei tassi di frattura negli uomini trattati con AVANDIA. Il rischio di frattura deve essere preso in considerazione nella cura dei pazienti, in particolare quelli di sesso femminile, trattati con AVANDIA e attenzione alla valutazione e al mantenimento della salute delle ossa secondo gli standard attuali di cura.
Effetti ematologici
La riduzione dell'emoglobina media e dell'ematocrito si è verificata in modo dose-dipendente nei pazienti adulti trattati con AVANDIA [vedere REAZIONI AVVERSE]. Le modifiche osservate possono essere correlate all'aumento del volume plasmatico osservato con il trattamento con AVANDIA.
Controllo del diabete e della glicemia
I pazienti che ricevono AVANDIA in associazione con altri agenti ipoglicemizzanti possono essere a rischio di ipoglicemia e può essere necessaria una riduzione della dose dell'agente concomitante.
Misurazioni periodiche della glicemia a digiuno e dell'HbA1c devono essere eseguite per monitorare la risposta terapeutica.
Ovulazione
La terapia con AVANDIA, come altre tiazolidinedioni, può provocare l'ovulazione in alcune donne anovulatorie in premenopausa. Di conseguenza, questi pazienti possono presentare un rischio maggiore di gravidanza durante l'assunzione di AVANDIA [vedi Utilizzare in popolazioni specifiche]. Pertanto, deve essere raccomandata un'adeguata contraccezione nelle donne in premenopausa. Questo possibile effetto non è stato specificamente studiato negli studi clinici; pertanto, la frequenza di questa occorrenza non è nota.
Sebbene uno squilibrio ormonale sia stato osservato in studi preclinici [vedi Tossicologia non clinica], il significato clinico di questo risultato non è noto. In caso di disfunzione mestruale imprevista, i benefici della terapia continua con AVANDIA devono essere rivisti.
superiore
Reazioni avverse
Esperienza di prova clinica
Adulto
Negli studi clinici, circa 9.900 pazienti con diabete di tipo 2 sono stati trattati con AVANDIA.
Prove a breve termine di AVANDIA come monoterapia e in combinazione con altri agenti ipoglicemizzanti
L'incidenza e i tipi di eventi avversi riportati negli studi clinici a breve termine di AVANDIA in monoterapia sono riportati nella Tabella 4.
Tabella 4 Eventi avversi (â ‰ ¥ 5% in qualsiasi gruppo di trattamento) riportati da pazienti in studi clinici a breve durata * in doppio cieco con AVANDIA in monoterapia
| Termine preferito | AVANDIA monoterapia N = 2.526 % |
Placebo N = 601 % |
Metformina N = 225 % |
Sulfonylureasâ € N = 626 % |
| Infezione del tratto respiratorio superiore | 9.9 | 8.7 | 8.9 | 7.3 |
| Infortunio | 7.6 | 4.3 | 7.6 | 6.1 |
| Mal di testa | 5.9 | 5.0 | 8.9 | 5.4 |
| Mal di schiena | 4.0 | 3.8 | 4.0 | 5.0 |
| Iperglicemia | 3.9 | 5.7 | 4.4 | 8.1 |
| Fatica | 3.6 | 5.0 | 4.0 | 1.9 |
| Sinusite | 3.2 | 4.5 | 5.3 | 3.0 |
| Diarrea | 2.3 | 3.3 | 15.6 | 3.0 |
| L'ipoglicemia | 0.6 | 0.2 | 1.3 | 5.9 |
|
* Le prove a breve termine sono andate da 8 settimane a 1 anno. †Comprende pazienti che ricevono glyburide (N = 514), gliclazide (N = 91) o glipizide (N = 21). |
Complessivamente, i tipi di reazioni avverse indipendentemente dalla causalità sono stati riportati quando è stato usato AVANDIA in combinazione con una sulfonilurea o metformina erano simili a quelli durante la monoterapia con Avandia.
Gli eventi di anemia ed edema tendevano a essere segnalati più frequentemente a dosi più elevate, e generalmente erano di gravità da lieve a moderata e di solito non richiedevano l'interruzione del trattamento con AVANDIA.
In studi in doppio cieco, è stata segnalata anemia nell'1,9% dei pazienti trattati con AVANDIA in monoterapia rispetto allo 0,7% con placebo, allo 0,6% con sulfoniluree e al 2,2% con metformina. Le segnalazioni di anemia erano maggiori nei pazienti trattati con una combinazione di AVANDIA e metformina (7,1%) e con una combinazione di AVANDIA e una sulfonilurea più metformina (6,7%) rispetto alla monoterapia con AVANDIA o in associazione con una sulfonilurea (2.3%). Bassi livelli di emoglobina / ematocrito pre-trattamento in pazienti arruolati negli studi clinici sulla combinazione di metformina possono aver contribuito a un più alto tasso di anemia in questi studi [vedere REAZIONI AVVERSE].
Negli studi clinici, l'edema è stato riportato nel 4,8% dei pazienti trattati con AVANDIA in monoterapia rispetto all'1,3% con placebo, all'1,0% con sulfaniluree e al 2,2% con metformina. Il tasso di segnalazione di edema è stato più elevato per AVANDIA 8 mg nelle combinazioni di sulfonilurea (12,4%) rispetto ad altre combinazioni, ad eccezione dell'insulina. Edema è stato riportato nel 14,7% dei pazienti trattati con AVANDIA negli studi di combinazione insulinica rispetto al 5,4% solo con insulina. Sono state riportate segnalazioni di nuova insorgenza o esacerbazione di insufficienza cardiaca congestizia a tassi dell'1% per l'insulina da sola e del 2% (4 mg) e 3% (8 mg) per l'insulina in associazione con AVANDIA [vedere AVVERTENZA CONFEZIONATA e AVVERTENZE E PRECAUZIONI].
In studi di terapia di combinazione controllata con sulfoniluree, sono stati riportati sintomi ipoglicemici da lievi a moderati, che sembrano essere correlati alla dose. Pochi pazienti sono stati ritirati per ipoglicemia (<1%) e pochi episodi di ipoglicemia sono stati considerati gravi (<1%). L'ipoglicemia è stato l'evento avverso più frequentemente riportato negli studi di combinazione di insulina a dose fissa, sebbene pochi pazienti si siano ritirati per ipoglicemia (4 su 408 per AVANDIA più insulina e 1 su 203 per insulina solo). I tassi di ipoglicemia, confermati dalla concentrazione di glucosio nel sangue capillare â € ¤ 50 mg / dL, sono stati del 6% per l'insulina da sola e del 12% (4 mg) e del 14% (8 mg) per insulina in associazione con AVANDIA. [Vedere AVVERTENZE E PRECAUZIONI.]
Prova a lungo termine di AVANDIA come monoterapia
Uno studio di 4-6 anni (ADOPT) ha confrontato l'uso di AVANDIA (n = 1.456), glyburide (n = 1.441) e metformina (n = 1.454) come monoterapia in pazienti recentemente diagnosticati con diabete di tipo 2 che non erano stati precedentemente trattati con antidiabetici farmaci. La tabella 5 presenta reazioni avverse indipendentemente dalla causalità; le percentuali sono espresse per esposizione su 100 pazienti-anno (PY) per tenere conto delle differenze nell'esposizione ai farmaci studiati nei 3 gruppi di trattamento.
In ADOPT, sono state riportate fratture in un numero maggiore di donne trattate con AVANDIA (9,3%, 2,7 / 100 pazienti-anno) rispetto a glyburide (3,5%, 1,3 / 100 anni-paziente) o metformina (5,1%, 1,5 / 100 pazienti-anno).
La maggior parte delle fratture nelle donne che hanno ricevuto rosiglitazone sono state riportate nella parte superiore del braccio, nella mano e nel piede. [Vedere AVVERTENZE E PRECAUZIONI.] L'incidenza osservata di fratture nei pazienti maschi è stata simile tra i 3 gruppi di trattamento.
Tabella 5 Eventi avversi in terapia (â ‰ ¥ 5 eventi / 100 pazienti-anno [PY]) in qualsiasi gruppo di trattamento riportato in una sperimentazione clinica di 4-6 anni di AVANDIA come monoterapia (ADOPT)
| AVANDIA N = 1.456 PY = 4.954 |
Glyburide N = 1.441 PY = 4.244 |
Metformina N = 1.454 PY = 4.906 |
|
| nasofaringite | 6.3 | 6.9 | 6.6 |
| Mal di schiena | 5.1 | 4.9 | 5.3 |
| artralgia | 5.0 | 4.8 | 4.2 |
| Ipertensione | 4.4 | 6.0 | 6.1 |
| Infezione del tratto respiratorio superiore | 4.3 | 5.0 | 4.7 |
| L'ipoglicemia | 2.9 | 13.0 | 3.4 |
| Diarrea | 2.5 | 3.2 | 6.8 |
pediatrico
Avandia è stata valutata per la sicurezza in un singolo studio controllato attivo di pazienti pediatrici con diabete di tipo 2 in cui 99 sono stati trattati con Avandia e 101 sono stati trattati con metformina. Le reazioni avverse più comuni (> 10%) indipendentemente dalla causalità per Avandia o metformina sono state mal di testa (17% contro 14%), nausea (4% contro 11%), rinofaringite (3% contro 12%) e diarrea (1% contro 13%). In questo studio, è stato riportato un caso di chetoacidosi diabetica nel gruppo metformina. Inoltre, c'erano 3 pazienti nel gruppo rosiglitazone con FPG di ¼ 300 mg / dL, 2+ chetonuria e un elevato gap anionico.
Anomalie di laboratorio
Ematologico
La riduzione dell'emoglobina media e dell'ematocrito si è verificata in modo dose-dipendente nei pazienti adulti trattati con Avandia (riduzione media negli studi individuali fino a 1,0 g / dL di emoglobina e fino al 3,3% ematocrito). I cambiamenti si sono verificati principalmente durante i primi 3 mesi dopo l'inizio della terapia con Avandia o dopo un aumento della dose in Avandia. Il decorso temporale e l'entità delle diminuzioni erano simili nei pazienti trattati con una combinazione di Avandia e altri agenti ipoglicemizzanti o in monoterapia con Avandia. I livelli pre-trattamento di emoglobina ed ematocrito erano più bassi nei pazienti negli studi sulla combinazione di metformina e potrebbero aver contribuito al più alto tasso di segnalazione di anemia. In un singolo studio su pazienti pediatrici, sono state riportate diminuzioni dell'emoglobina e dell'ematocrito (rispettivamente diminuzioni medie di 0,29 g / dL e 0,95%). Piccole diminuzioni dell'emoglobina e dell'ematocrito sono state riportate anche in pazienti pediatrici trattati con Avandia. Anche la conta dei globuli bianchi è leggermente diminuita nei pazienti adulti trattati con Avandia. La riduzione dei parametri ematologici può essere correlata all'aumento del volume plasmatico osservato con il trattamento con Avandia.
lipidi
Sono stati osservati cambiamenti nei lipidi sierici a seguito del trattamento con Avandia negli adulti [vedi Farmacologia clinica ]. Piccoli cambiamenti nei parametri sierici dei lipidi sono stati riportati nei bambini trattati con Avandia per 24 settimane.
Livelli sierici di transaminasi
In studi clinici pre-approvazione su 4.598 pazienti trattati con Avandia (3.600 pazienti-anni di esposizione) e in un Studio di 6 anni su 1.456 pazienti trattati con Avandia (4.954 pazienti-anni di esposizione), non ci sono prove di induzione da farmaci epatotossicità.
In studi controllati pre-approvazione, lo 0,2% dei pazienti trattati con Avandia presentava aumenti di ALT> 3X il limite superiore della norma rispetto allo 0,2% su placebo e allo 0,5% su comparatori attivi. Gli aumenti di ALT nei pazienti trattati con Avandia erano reversibili. L'iperbilirubinemia è stata trovata nello 0,3% dei pazienti trattati con Avandia rispetto allo 0,9% trattato con placebo e all'1% nei pazienti trattati con comparatori attivi. Negli studi clinici pre-approvazione, non vi sono stati casi di reazioni farmacologiche idiosincratiche che hanno portato a insufficienza epatica. [Vedere Avvertenze e precauzioni]
Nello studio ADOPT da 4 a 6 anni, i pazienti trattati con Avandia (4.954 anni di esposizione per pazienti), gliburide (4.244 anni di esposizione per pazienti) o la metformina (4.906 anni-paziente di esposizione), in monoterapia, ha avuto lo stesso tasso di aumento di ALT fino a> 3 volte il limite superiore del normale (0,3 per 100 pazienti-anno esposizione).
Esperienza post-marketing
Oltre alle reazioni avverse riportate da studi clinici, gli eventi descritti di seguito sono stati identificati durante l'uso post-approvazione di Avandia. Poiché questi eventi sono segnalati volontariamente da una popolazione di dimensioni sconosciute, non è possibile stimare in modo affidabile la loro frequenza o stabilire sempre una relazione causale con l'esposizione al farmaco.
Nei pazienti in terapia con tiazolidinedione, eventi avversi gravi con o senza esito fatale, potenzialmente correlati all'espansione del volume (ad es. insufficienza cardiaca congestizia, edema polmonare ed effusioni pleuriche) sono stati riportati [vedere Avviso in scatola e Avvertenze e precauzioni].
Esistono segnalazioni postmarketing con Avandia di epatite, aumenti degli enzimi epatici a 3 o più volte limite superiore dell'insufficienza normale ed epatica con e senza esito fatale, sebbene la causalità non sia stata stabilito.
Rash, prurito, orticaria, angioedema, reazione anafilattica e sindrome di Stevens-Johnson sono stati segnalati raramente.
Sono state anche ricevute segnalazioni di nuova insorgenza o peggioramento dell'edema maculare diabetico con ridotta acuità visiva [vedi Avvertenze e precauzioni].
superiore
Interazioni farmacologiche
Inibitori e induttori del CYP2C8
Un inibitore del CYP2C8 (ad es. Gemfibrozil) può aumentare l'AUC del rosiglitazone e un induttore del CYP2C8 (ad es. Rifampicina) può ridurre l'AUC del rosiglitazone. Pertanto, se un inibitore o un induttore del CYP2C8 viene avviato o interrotto durante il trattamento con rosiglitazone, possono essere necessari cambiamenti nella terapia del diabete in base alla risposta clinica. [Vedere FARMACOLOGIA CLINICA.]
superiore
Utilizzare in popolazioni specifiche
Gravidanza
Categoria di gravidanza C.
Tutte le gravidanze hanno un rischio di fondo di difetti alla nascita, perdita o altri esiti avversi indipendentemente dall'esposizione al farmaco. Questo rischio di fondo è aumentato nelle gravidanze complicate da iperglicemia e può essere ridotto con un buon controllo metabolico. È essenziale per i pazienti con diabete o storia di diabete gestazionale mantenere un buon controllo metabolico prima del concepimento e durante la gravidanza. Un attento monitoraggio del controllo del glucosio è essenziale in tali pazienti. La maggior parte degli esperti raccomanda di utilizzare la monoterapia con insulina durante la gravidanza per mantenere i livelli di glucosio nel sangue il più vicino possibile al normale.
Dati umani: È stato riportato che il rosiglitazone attraversa la placenta umana e si trova nel tessuto fetale. Il significato clinico di questi risultati non è noto. Non esistono studi adeguati e ben controllati su donne in gravidanza. AVANDIA non deve essere usato durante la gravidanza.
Studi sugli animali: Non ci sono stati effetti sull'impianto o sull'embrione con trattamento con rosiglitazone durante la gravidanza precoce nei ratti, ma il trattamento durante la gestazione medio-tardiva era associato a morte fetale e ritardo della crescita sia nei ratti che nei conigli. La teratogenicità non è stata osservata a dosi fino a 3 mg / kg nei ratti e 100 mg / kg nei conigli (circa 20 e 75 volte l'AUC umana alla dose giornaliera massima raccomandata nell'uomo, rispettivamente). Il rosiglitazone ha causato patologia placentare nei ratti (3 mg / kg / giorno). Il trattamento dei ratti durante la gestazione attraverso l'allattamento ha ridotto le dimensioni della figliata, la vitalità neonatale e la crescita postnatale, con ritardo della crescita reversibile dopo la pubertà. Per effetti sulla placenta, sull'embrione / feto e sulla prole, la dose senza effetto era di 0,2 mg / kg / die nei ratti e 15 mg / kg / die nei conigli. Questi livelli senza effetto sono circa 4 volte l'AUC umana alla massima dose giornaliera raccomandata nell'uomo. Il rosiglitazone ha ridotto il numero di impianti uterini e la prole viva quando le femmine di ratto giovanile sono state trattate a 40 anni mg / kg / giorno dai 27 giorni di età fino alla maturità sessuale (circa 68 volte l'AUC umana al massimo giornaliero raccomandato dose). Il livello senza effetto era di 2 mg / kg / die (circa 4 volte l'AUC umana alla dose giornaliera massima raccomandata). Non vi sono stati effetti sulla sopravvivenza o sulla crescita pre o post natale.
Lavoro e consegna
Non è noto l'effetto del rosiglitazone sul travaglio e sul parto nell'uomo.
Madri che allattano
Materiale correlato al farmaco è stato rilevato nel latte dai ratti in allattamento. Non è noto se AVANDIA sia escreto nel latte materno. Poiché molti farmaci vengono escreti nel latte materno, AVANDIA non deve essere somministrato a donne che allattano.
Uso pediatrico
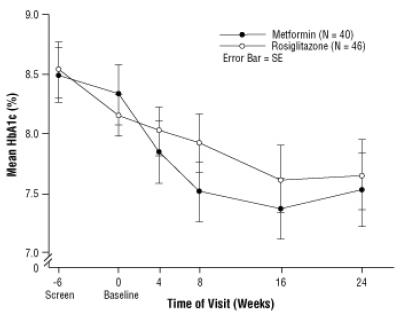
Dopo il rodaggio con placebo, inclusa la consulenza dietetica, i bambini con diabete mellito di tipo 2, di età compresa tra 10 e 17 anni e con un indice di massa corporea (BMI) basale di 33 kg / m, sono stati randomizzati al trattamento con 2 mg due volte al giorno di AVANDIA (n = 99) o 500 mg due volte al giorno di metformina (n = 101) in una clinica in doppio cieco di 24 settimane prova. Come previsto, l'FPG è diminuito nei pazienti che non assumevano farmaci per il diabete (n = 104) e aumentava nei pazienti ritirati dal precedente trattamento (di solito metformina) (n = 90) durante il periodo di rodaggio. Dopo almeno 8 settimane di trattamento, il 49% dei pazienti trattati con AVANDIA e il 55% dei pazienti trattati con metformina hanno avuto una dose raddoppiata se FPG> 126 mg / dL. Per la popolazione generale intent-to-treat, alla settimana 24, la variazione media dal basale in HbA1c era -0,14% con AVANDIA e -0,49% con metformina. In questo studio c'era un numero insufficiente di pazienti per stabilire statisticamente se questi
gli effetti di trattamento medi osservati erano simili o diversi. Gli effetti del trattamento differivano per i pazienti non sottoposti a terapia con farmaci antidiabetici e per i pazienti precedentemente trattati con terapia antidiabetica (Tabella 6).
Tabella 6 Cambio FPG e HbA1c della settimana 24 rispetto all'ultima osservazione al basale portato avanti nei bambini con HbA1c al basale> 6,5%
| Naïve Patients | Pazienti precedentemente trattati | |||
|
Metformina N = 40 |
rosiglitazone N = 45 |
Metformina N = 43 |
rosiglitazone N = 32 |
|
| FPG (mg / dL) | ||||
| Linea di base (media) | 170 | 165 | 221 | 205 |
| Variazione rispetto al basale (media) | -21 | -11 | -33 | -5 |
| Differenza terapeutica corretta * (rosiglitazone-metformina) â € (IC al 95%) | 8 (-15, 30) |
21 (-9, 51) |
||
| % di pazienti con ‰ ¥ 30 mg / dL diminuisce rispetto al basale | 43% | 27% | 44% | 28% |
| HbA1c (%) | ||||
| Linea di base (media) | 8.3 | 8.2 | 8.8 | 8.5 |
| Variazione rispetto al basale (media) | -0.7 | -0.5 | -0.4 | 0.1 |
| Differenza terapeutica corretta * (rosiglitazone-metformina) â € (IC al 95%) | 0.2 (-0.6, 0.9) |
0.5 (-0.2, 1.3) |
||
| % di pazienti con 0.7 ¥ 0,7% in diminuzione rispetto al basale | 63% | 52% | 54% | 31% |
|
* Il cambiamento rispetto al basale significa che i minimi quadrati significa aggiustare per il basale HbA1c, genere e regione. †Valori positivi per la differenza favoriscono la metformina. |
Le differenze di trattamento dipendevano dall'IMC o dal peso basale in modo tale che gli effetti di AVANDIA e metformina apparivano più strettamente comparabili tra i pazienti più pesanti. L'aumento di peso mediano è stato di 2,8 kg con rosiglitazone e 0,2 kg con metformina [vedi AVVERTENZE E PRECAUZIONI]. Il cinquantaquattro percento dei pazienti trattati con rosiglitazone e il 32% dei pazienti trattati con metformina hanno ottenuto â ‰ ¥ 2 kg e il 33% dei pazienti trattati con rosiglitazone e il 7% dei pazienti trattati con metformina hanno guadagnato â 5 ¥ 5 kg su studia.
Gli eventi avversi osservati in questo studio sono descritti in Reazioni avverse).
Figura 3 HbA1c medio nel tempo in uno studio di 24 settimane di AVANDIA e metformina in pazienti pediatrici - Sottogruppo di farmaci Naïve
Uso geriatrico
I risultati dell'analisi farmacocinetica di popolazione hanno mostrato che l'età non influisce in modo significativo sulla farmacocinetica del rosiglitazone [vedi FARMACOLOGIA CLINICA]. Pertanto, non sono richiesti aggiustamenti del dosaggio per gli anziani. In studi clinici controllati, non sono state osservate differenze generali in termini di sicurezza ed efficacia tra pazienti più anziani (65 65 anni) e più giovani (<65 anni).
superiore
sovradosaggio
Sono disponibili dati limitati sul sovradosaggio nell'uomo. Negli studi clinici su volontari, AVANDIA è stato somministrato a dosi orali singole fino a 20 mg ed è stato ben tollerato. In caso di sovradosaggio, deve essere iniziato un adeguato trattamento di supporto come stabilito dallo stato clinico del paziente.
superiore
Descrizione
AVANDIA (rosiglitazone maleato) è un agente antidiabetico orale che agisce principalmente aumentando la sensibilità all'insulina. AVANDIA migliora il controllo glicemico riducendo i livelli circolanti di insulina.
Il rosiglitazone maleato non è chimicamente o funzionalmente correlato alle sulfoniluree, alle biguanidi o agli inibitori dell'alfa-glucosidasi.
Chimicamente, il rosiglitazone maleato è (±) -5 - [[4- [2- (metil-2-piridinilammino) etossi] fenil] metil] -2,4-tiazolidinedione, (Z) -2-butenedioato (1: 1) con un peso molecolare di 473,52 (357,44 base libera). La molecola ha un solo centro chirale ed è presente come racemato. A causa della rapida interconversione, gli enantiomeri sono funzionalmente indistinguibili. La formula strutturale del rosiglitazone maleato è:
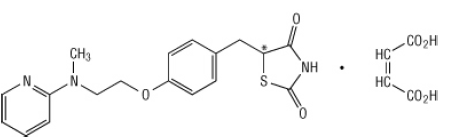
La formula molecolare è C18H19N3O3S-C4H4O4. Il rosiglitazone maleato è un solido da bianco a biancastro con un intervallo di punti di fusione da 122 a 123 ° C. I valori di pKa del rosiglitazone maleato sono 6,8 e 6,1. È facilmente solubile in etanolo e a soluzione acquosa tamponata con pH di 2,3; la solubilità diminuisce con l'aumentare del pH fisiologico gamma.
Ogni compressa pentagonale di TILTAB rivestita con film contiene rosiglitazone maleato equivalente a rosiglitazone, 2 mg, 4 mg o 8 mg, per somministrazione orale. Gli ingredienti inattivi sono: ipromellosa 2910, lattosio monoidrato, magnesio stearato, cellulosa microcristallina, polietilenglicole 3000, amido glicolato di sodio, biossido di titanio, triacetina e 1 o più dei seguenti: ossidi di ferro rosso e giallo sintetici e talco.
superiore
Farmacologia clinica
Meccanismo di azione
Il rosiglitazone, un membro della classe tiazolidinedione di agenti antidiabetici, migliora il controllo glicemico migliorando la sensibilità all'insulina. Il rosiglitazone è un agonista altamente selettivo e potente per il recettore-gamma attivato dal proliferatore del perossisoma (PPAR³). Nell'uomo, i recettori PPAR si trovano nei tessuti target chiave per l'azione dell'insulina come il tessuto adiposo, il muscolo scheletrico e il fegato. L'attivazione dei recettori nucleari PPARβ regola la trascrizione dei geni insulino-sensibili coinvolti nel controllo della produzione, trasporto e utilizzo del glucosio. Inoltre, anche i geni sensibili al PPARα partecipano alla regolazione del metabolismo degli acidi grassi.
La resistenza all'insulina è una caratteristica comune che caratterizza la patogenesi del diabete di tipo 2. L'attività antidiabetica del rosiglitazone è stata dimostrata in modelli animali di diabete di tipo 2 nel quale iperglicemia e / o ridotta tolleranza al glucosio è una conseguenza della resistenza all'insulina nel target tessuti. Il rosiglitazone riduce le concentrazioni di glucosio nel sangue e riduce l'iperinsulinemia nel topo ob / ob obeso, nel topo diabetico db / db e nel ratto grasso Zucker fa / fa.
Nei modelli animali, l'attività antidiabetica del rosiglitazone è stata dimostrata mediata da una maggiore sensibilità all'azione dell'insulina nel fegato, nei muscoli e nei tessuti adiposi. Studi farmacologici su modelli animali indicano che il rosiglitazone inibisce la gluconeogenesi epatica. L'espressione del trasportatore di glucosio insulino-regolato GLUT-4 era aumentata nel tessuto adiposo. Il rosiglitazone non ha indotto ipoglicemia nei modelli animali di diabete di tipo 2 e / o alterata tolleranza al glucosio.
farmacodinamica
I pazienti con anomalie lipidiche non sono stati esclusi dagli studi clinici su AVANDIA.
In tutti gli studi controllati della durata di 26 settimane, nell'intervallo di dosi raccomandato, AVANDIA in monoterapia è stata associata ad aumenti del colesterolo totale, LDL e HDL e alla riduzione degli acidi grassi liberi. Questi cambiamenti erano statisticamente significativamente diversi dai controlli con placebo o glyburide (Tabella 7).
Gli aumenti di LDL si sono verificati principalmente durante i primi 1-2 mesi di terapia con AVANDIA e i livelli di LDL sono rimasti elevati al di sopra del basale durante gli studi. Al contrario, l'HDL ha continuato a crescere nel tempo. Di conseguenza, il rapporto LDL / HDL ha raggiunto il picco dopo 2 mesi di terapia e quindi è sembrato diminuire nel tempo. A causa della natura temporale delle alterazioni lipidiche, lo studio di 52 settimane controllato con glyburide è più pertinente per valutare gli effetti a lungo termine sui lipidi. Al basale, settimana 26 e settimana 52, i rapporti LDL / HDL medi erano rispettivamente 3,1, 3,2 e 3,0 per AVANDIA 4 mg due volte al giorno. I valori corrispondenti per glyburide erano 3.2, 3.1 e 2.9. Le differenze nella variazione rispetto al basale tra AVANDIA e glyburide alla settimana 52 erano statisticamente significative.
Lo schema di LDL e HDL cambia in seguito alla terapia con AVANDIA in combinazione con altri agenti ipoglicemizzanti erano generalmente simili a quelli osservati con AVANDIA in monoterapia.
I cambiamenti nei trigliceridi durante la terapia con AVANDIA erano variabili e generalmente non erano statisticamente diversi dai controlli con placebo o glyburide.
Tabella 7 Riassunto delle variazioni medie dei lipidi negli studi di monoterapia a 26 settimane controllati con placebo e glicopride a 52 settimane
| Settimana 26 di studi controllati con placebo | Settimana di studio controllata da Glyburide 26 e settimana 52 | ||||||
| Placebo | AVANDIA | Titolazione Glyburide | AVANDIA 8 mg | ||||
| 4 mg al giorno * | 8 mg al giorno * | Sett. 26 | Sett 52 | Sett. 26 | Sett 52 | ||
| Acidi grassi liberi | |||||||
| N | 207 | 428 | 436 | 181 | 168 | 166 | 145 |
| % Basale (media) | 18.1 | 17.5 | 17.9 | 26.4 | 26.4 | 26.9 | 26.6 |
| Variazione rispetto al basale (media) | +0.2% | -7.8% | -14.7% | -2.4% | -4.7% | -20.8% | -21.5% |
| LDL | |||||||
| N | 190 | 400 | 374 | 175 | 160 | 161 | 133 |
| % Basale (media) | 123.7 | 126.8 | 125.3 | 142.7 | 141.9 | 142.1 | 142.1 |
| Variazione rispetto al basale (media) | +4.8% | +14.1% | +18.6% | -0.9% | -0.5% | +11.9% | +12.1% |
| HDL | |||||||
| N | 208 | 429 | 436 | 184 | 170 | 170 | 145 |
| % Basale (media) | 44.1 | 44.4 | 43.0 | 47.2 | 47.7 | 48.4 | 48.3 |
| Variazione rispetto al basale (media) | +8.0% | +11.4% | +14.2% | +4.3% | +8.7% | +14.0% | +18.5% |
| * Sono stati combinati gruppi di dosaggio una volta al giorno e due volte al giorno. |
farmacocinetica
La concentrazione plasmatica massima (Cmax) e l'area sotto la curva (AUC) del rosiglitazone aumentano in modo proporzionale alla dose nell'intervallo di dosi terapeutiche (Tabella 8). L'emivita di eliminazione è di 3-4 ore ed è indipendente dalla dose.
Tabella 8 Parametri farmacocinetici medi (DS) per rosiglitazone a seguito di dosi orali singole (N = 32)
| Parametro | 1 mg a digiuno | 2 mg di digiuno | 8 mg di digiuno | 8 mg Fed |
| AUC0-inf [Ng-h / ml] |
358 (112) |
733 (184) |
2,971 (730) |
2,890 (795) |
| Cmax [Ng / ml] |
76 (13) |
156 (42) |
598 (117) |
432 (92) |
| Metà vita [Hr] |
3.16 (0.72) |
3.15 (0.39) |
3.37 (0.63) |
3.59 (0.70) |
| CL / F * [L / hr] |
3.03 (0.87) |
2.89 (0.71) |
2.85 (0.69) |
2.97 (0.81) |
| * CL / F = Gioco orale. |
Assorbimento
La biodisponibilità assoluta di rosiglitazone è del 99%. Le concentrazioni plasmatiche di picco si osservano circa 1 ora dopo la somministrazione. La somministrazione di rosiglitazone con il cibo non ha comportato variazioni nell'esposizione complessiva (AUC), ma si è verificata una riduzione di circa il 28% nella Cmax e un ritardo nella Tmax (1,75 ore). È improbabile che questi cambiamenti siano clinicamente significativi; pertanto, AVANDIA può essere somministrato con o senza cibo.
Distribuzione
Il volume medio (CV%) di distribuzione orale (Vss / F) di rosiglitazone è di circa 17,6 (30%) litri, sulla base di un'analisi farmacocinetica di popolazione. Il rosiglitazone si lega per circa il 99,8% alle proteine plasmatiche, principalmente all'albumina.
Metabolismo
Il rosiglitazone viene ampiamente metabolizzato senza alcun farmaco immodificato escreto nelle urine. Le principali vie del metabolismo erano la N-demetilazione e l'idrossilazione, seguite dalla coniugazione con solfato e acido glucuronico. Tutti i metaboliti circolanti sono considerevolmente meno potenti dei genitori e, pertanto, non si prevede che contribuiscano all'attività insulino-sensibile di rosiglitazone.
I dati in vitro dimostrano che il rosiglitazone è metabolizzato prevalentemente dall'isoenzima 2C8 del citocromo P450 (CYP), con il CYP2C9 che contribuisce come via minore.
Escrezione
Dopo somministrazione orale o endovenosa di [14C] rosiglitazone maleato, circa il 64% e il 23% della dose sono stati eliminati rispettivamente nelle urine e nelle feci. L'emivita plasmatica del materiale correlato al [14C] variava da 103 a 158 ore.
Farmacocinetica di popolazione in pazienti con diabete di tipo 2
Analisi farmacocinetiche di popolazione provenienti da 3 grandi studi clinici di cui 642 uomini e 405 donne con diabete di tipo 2 (35 anni a 80 anni) hanno mostrato che la farmacocinetica del rosiglitazone non è influenzata dall'età, dalla razza, dal fumo o dall'alcool consumo. Sia la clearance orale (CL / F) che il volume di distribuzione orale allo stato stazionario (Vss / F) hanno mostrato di aumentare con l'aumento del peso corporeo. Nell'intervallo di peso osservato in queste analisi (da 50 a 150 kg), l'intervallo di valori CL / F e Vss / F previsti variava rispettivamente da <1,7 volte e <2,3 volte.
Inoltre, il rosiglitazone CL / F ha mostrato di essere influenzato sia dal peso che dal sesso, essendo più basso (circa il 15%) nelle pazienti di sesso femminile.
Popolazioni speciali
geriatrico
Risultati dell'analisi farmacocinetica di popolazione (n = 716 <65 anni; n = 331 â 65 ¥ 65 anni) ha dimostrato che l'età non influisce in modo significativo sulla farmacocinetica del rosiglitazone.
Genere
I risultati dell'analisi di farmacocinetica di popolazione hanno mostrato che la clearance orale media di rosiglitazone in le pazienti di sesso femminile (n = 405) erano circa il 6% inferiori rispetto ai pazienti di sesso maschile di pari peso corporeo (n = 642).
Come monoterapia e in combinazione con metformina, AVANDIA ha migliorato il controllo glicemico sia negli uomini che nelle donne. Negli studi di combinazione con metformina, l'efficacia è stata dimostrata senza differenze di genere nella risposta glicemica.
Negli studi in monoterapia, è stata osservata una maggiore risposta terapeutica nelle donne; tuttavia, nei pazienti più obesi, le differenze di genere erano meno evidenti. Per un dato indice di massa corporea (BMI), le femmine tendono ad avere una massa grassa maggiore rispetto ai maschi. Poiché il target molecolare PPARα è espresso nei tessuti adiposi, questa caratteristica differenziante può spiegare, almeno in parte, la maggiore risposta ad AVANDIA nelle femmine. Poiché la terapia deve essere personalizzata, non è necessario alcun aggiustamento della dose in base al solo sesso.
Insufficienza epatica
La clearance orale non legata di rosiglitazone era significativamente più bassa nei pazienti con malattia epatica da moderata a grave (classe B / C Child-Pugh) rispetto ai soggetti sani. Di conseguenza, Cmax e AUC0-inf non associati sono stati aumentati rispettivamente di 2 e 3 volte. L'emivita di eliminazione del rosiglitazone è stata di circa 2 ore in più nei pazienti con malattia epatica, rispetto ai soggetti sani.
La terapia con AVANDIA non deve essere iniziata se il paziente presenta evidenza clinica di attività attiva malattia epatica o aumento dei livelli sierici di transaminasi (ALT> 2,5 volte il limite superiore del normale) al basale [vedere AVVERTENZE E PRECAUZIONI].
pediatrico
I parametri farmacocinetici di rosiglitazone nei pazienti pediatrici sono stati stabiliti utilizzando un'analisi farmacocinetica di popolazione con dati radi da 96 pazienti pediatrici in un singolo studio clinico pediatrico di cui 33 maschi e 63 femmine con età compresa tra 10 e 17 anni (pesi che vanno da 35 a 178,3 kg). La media della popolazione CL / F e V / F di rosiglitazone era rispettivamente di 3,15 L / ora e 13,5 L. Queste stime di CL / F e V / F erano coerenti con le stime dei parametri tipici di una precedente analisi della popolazione adulta.
Insufficienza renale
Non ci sono differenze clinicamente rilevanti nella farmacocinetica di rosiglitazone in pazienti con lieve a grave insufficienza renale o in pazienti dipendenti dall'emodialisi rispetto a soggetti con insufficienza renale normale funzione. Non è pertanto necessario alcun aggiustamento del dosaggio in tali pazienti in trattamento con AVANDIA. Poiché la metformina è controindicata nei pazienti con insufficienza renale, la co-somministrazione di metformina con AVANDIA è controindicata in questi pazienti.
Gara
I risultati di un'analisi farmacocinetica di popolazione comprendente soggetti di origine etnica caucasica, nera e di altro tipo indicano che la razza non ha alcuna influenza sulla farmacocinetica del rosiglitazone.
Interazioni farmaco-farmaco
Farmaci che inibiscono, inducono o sono metabolizzati dal citocromo P450
Gli studi sul metabolismo dei farmaci in vitro suggeriscono che il rosiglitazone non inibisce nessuno dei principali enzimi P450 a concentrazioni clinicamente rilevanti. I dati in vitro dimostrano che il rosiglitazone viene metabolizzato prevalentemente dal CYP2C8 e, in misura minore, dal 2C9. AVANDIA (4 mg due volte al giorno) non ha mostrato effetti clinicamente rilevanti sulla farmacocinetica di nifedipina e contraccettivi orali (etinilestradiolo e noretindrone), che sono prevalentemente metabolizzati di CYP3A4.
gemfibrozil
Somministrazione concomitante di gemfibrozil (600 mg due volte al giorno), un inibitore del CYP2C8 e rosiglitazone (4 mg una volta quotidianamente) per 7 giorni ha aumentato l'AUC del rosiglitazone del 127%, rispetto alla somministrazione di rosiglitazone (4 mg una volta al giorno) solo. Dato il potenziale di eventi avversi correlati alla dose con rosiglitazone, può essere necessaria una riduzione della dose di rosiglitazone quando viene introdotto gemfibrozil [vedere INTERAZIONI CON DROGA].
rifampicina
È stato riferito che la somministrazione di rifampicina (600 mg una volta al giorno), un induttore del CYP2C8, per 6 giorni riduce l'AUC di rosiglitazone del 66%, rispetto alla somministrazione di rosiglitazone (8 mg) da solo [vedi INTERAZIONI CON DROGA].4
Glyburide
AVANDIA (2 mg due volte al giorno) assunto in concomitanza con glyburide (3,75-10 mg / die) per 7 giorni non ha subito alterazioni le concentrazioni medie di glucosio plasmatico a 24 ore allo stato stazionario nei pazienti diabetici si sono stabilizzate su glicburide terapia. Ripetere le dosi di AVANDIA (8 mg una volta al giorno) per 8 giorni in soggetti caucasici adulti sani ha provocato una riduzione dell'AUC e della Cmax del glucide di circa il 30%. In soggetti giapponesi, AUC e Cmax di glyburide sono leggermente aumentati dopo la somministrazione concomitante di AVANDIA.
glimepiride
Dosi singole orali di glimepiride in 14 soggetti adulti sani non hanno avuto effetti clinicamente significativi sulla farmacocinetica allo stato stazionario di AVANDIA. Nessuna riduzione clinicamente significativa dell'AUC e C della glimepiridemax sono stati osservati dopo dosi ripetute di AVANDIA (8 mg una volta al giorno) per 8 giorni in soggetti adulti sani.
Metformina
Somministrazione concomitante di AVANDIA (2 mg due volte al giorno) e metformina (500 mg due volte al giorno) in buona salute i volontari per 4 giorni non hanno avuto alcun effetto sulla farmacocinetica allo stato stazionario di metformina o rosiglitazone.
acarbose
La somministrazione concomitante di acarbosio (100 mg tre volte al giorno) per 7 giorni in volontari sani non ha avuto effetti clinicamente rilevanti sulla farmacocinetica di una singola dose orale di AVANDIA.
digossina
Ripetere la somministrazione orale di AVANDIA (8 mg una volta al giorno) per 14 giorni non ha alterato la farmacocinetica allo stato stazionario della digossina (0,375 mg una volta al giorno) in volontari sani.
warfarin
La ripetizione della somministrazione di AVANDIA non ha avuto effetti clinicamente rilevanti sulla farmacocinetica allo stato stazionario degli enantiomeri di warfarin.
etanolo
Una singola somministrazione di una moderata quantità di alcol non ha aumentato il rischio di ipoglicemia acuta nei pazienti con diabete mellito di tipo 2 trattati con AVANDIA.
ranitidina
Il pretrattamento con ranitidina (150 mg due volte al giorno per 4 giorni) non ha alterato la farmacocinetica di dosi singole orali o endovenose di rosiglitazone in volontari sani.
Questi risultati suggeriscono che l'assorbimento del rosiglitazone orale non è alterato in condizioni accompagnate da aumenti del pH gastrointestinale.
superiore
Tossicologia non clinica
Cancerogenesi, mutagenesi, alterazione della fertilità
carcinogenesi:
Uno studio di cancerogenicità di 2 anni è stato condotto su topi CD-1 Charles River a dosi di 0,4, 1,5 e 6 mg / kg / die in la dieta (dose massima equivalente a circa 12 volte l'AUC umana alla dose massima giornaliera raccomandata nell'uomo dose). I ratti Sprague-Dawley sono stati dosati per 2 anni con gavage orale a dosi di 0,05, 0,3 e 2 mg / kg / giorno (dose massima equivalente a circa 10 e 20 volte l'AUC umana alla massima dose giornaliera raccomandata nell'uomo per ratti maschi e femmine, rispettivamente).
Il rosiglitazone non era cancerogeno nel topo. C'è stato un aumento dell'incidenza di iperplasia adiposa nel topo a dosi di 1,5 mg / kg / die (circa 2 volte l'AUC umana alla dose giornaliera massima raccomandata nell'uomo). Nei ratti, si è verificato un aumento significativo dell'incidenza di tumori del tessuto adiposo benigno (lipomi) a dosi 0,3 mg / kg / die (circa 2 volte l'AUC umana alla dose giornaliera massima raccomandata nell'uomo). Questi cambiamenti proliferativi in entrambe le specie sono considerati a causa della persistente sovrastimolazione farmacologica del tessuto adiposo.
mutagenesi:
Il rosiglitazone non è risultato mutageno o clastogenico nei test batterici in vitro per la mutazione genetica, in vitro test di aberrazione cromosomica nei linfociti umani, test del micronucleo di topo in vivo e UDS di ratto in vivo / in vitro dosaggio. C'è stato un piccolo (circa 2 volte) aumento della mutazione nel test del linfoma del topo in vitro in presenza di attivazione metabolica.
Compromissione della fertilità:
Il rosiglitazone non ha avuto effetti sull'accoppiamento o sulla fertilità dei ratti maschi somministrati fino a 40 mg / kg / die (circa 116 volte l'AUC umana alla massima dose giornaliera raccomandata nell'uomo). Il rosiglitazone ha alterato la ciclicità estro (2 mg / kg / giorno) e ridotta fertilità (40 mg / kg / giorno) delle femmine di ratto in associazione con livelli plasmatici di progesterone ed estradiolo (circa 20 e 200 volte l'AUC umana alla massima dose giornaliera raccomandata nell'uomo, rispettivamente). Non sono stati osservati tali effetti a 0,2 mg / kg / die (circa 3 volte l'AUC umana alla dose giornaliera massima raccomandata nell'uomo). Nei ratti giovani somministrati a partire dai 27 giorni di età fino alla maturità sessuale (fino a 40 mg / kg / giorno), non si sono verificati effetti sulla performance riproduttiva maschile, o sulla ciclicità estro, le prestazioni di accoppiamento o l'incidenza della gravidanza nelle donne (circa 68 volte l'AUC umana alla massima dose giornaliera raccomandata nell'uomo dose). Nelle scimmie, rosiglitazone (0,6 e 4,6 mg / kg / giorno; circa 3 e 15 volte l'AUC umana alla dose giornaliera massima raccomandata nell'uomo, rispettivamente) hanno diminuito l'innalzamento della fase follicolare nell'estradiolo sierico con conseguente riduzione dell'ondata di ormone luteinizzante, livelli più bassi di progesterone in fase luteale e amenorrea. Il meccanismo di questi effetti sembra essere l'inibizione diretta della steroidogenesi ovarica.
Tossicologia animale
Il peso del cuore è aumentato nei topi (3 mg / kg / die), nei ratti (5 mg / kg / die) e nei cani (2 mg / kg / die) con rosiglitazone trattamenti (circa 5, 22 e 2 volte l'AUC umana alla dose giornaliera massima raccomandata nell'uomo, rispettivamente). Gli effetti nei ratti giovani erano coerenti con quelli osservati negli adulti. La misurazione morfometrica indicava che vi era ipertrofia nei tessuti ventricolari cardiaci, che potrebbe essere dovuta all'aumento del lavoro cardiaco a causa dell'espansione del volume plasmatico.
superiore
Studi clinici
monoterapia
Negli studi clinici, il trattamento con AVANDIA ha comportato un miglioramento del controllo glicemico, misurato da FPG e HbA1c, con una riduzione concomitante dell'insulina e del peptide C. Anche il glucosio postprandiale e l'insulina sono stati ridotti. Ciò è coerente con il meccanismo d'azione di AVANDIA come sensibilizzatore dell'insulina.
La dose giornaliera massima raccomandata è di 8 mg. Studi sulla dose hanno suggerito che non è stato ottenuto alcun beneficio aggiuntivo con una dose giornaliera totale di 12 mg.
Studi clinici a breve termine: Un totale di 2.315 pazienti con diabete di tipo 2, precedentemente trattati con una sola dieta o con farmaci antidiabetici, sono stati trattati con AVANDIA come monoterapia in 6 in doppio cieco studi, che includevano due studi controllati verso placebo della durata di 26 settimane, uno studio controllato sulla gliceride della durata di 52 settimane e 3 studi controllati sulla dose della placebo della durata di 8-12 settimane. I precedenti farmaci antidiabetici sono stati ritirati e i pazienti sono entrati in un periodo di rodaggio del placebo da 2 a 4 settimane prima della randomizzazione.
Due studi di 26 settimane, in doppio cieco, controllati con placebo, in pazienti con diabete di tipo 2 (n = 1.401) con glicemico inadeguato controllo (FPG basale medio circa 228 mg / dL [da 101 a 425 mg / dL] e HbA1c basale medio 8,9% [5,2% - 16,2%]) erano condotto. Il trattamento con AVANDIA ha prodotto miglioramenti statisticamente significativi di FPG e HbA1c rispetto al basale e rispetto al placebo. I dati di uno di questi studi sono riassunti nella Tabella 9.
Tabella 9: parametri glicemici in una prova controllata con placebo da 26 settimane
| Placebo N = 173 |
AVANDIA | AVANDIA | |||
| 4 mg una volta al giorno N = 180 |
2 mg due volte al giorno N = 186 |
8 mg una volta al giorno N = 181 |
4 mg due volte al giorno N = 187 |
||
| FPG (mg / dL) | |||||
| Linea di base (media) | 225 | 229 | 225 | 228 | 228 |
| Variazione rispetto al basale (media) | 8 | -25 | -35 | -42 | -55 |
| Differenza rispetto al placebo (media aggiustata) | - | -31* | -43* | -49* | -62* |
| % di pazienti con ‰ ¥ 30 mg / dL diminuisce rispetto al basale | 19% | 45% | 54% | 58% | 70% |
| HbA1c (%) | |||||
| Linea di base (media) | 8.9 | 8.9 | 8.9 | 8.9 | 9.0 |
| Variazione rispetto al basale (media) | 0.8 | 0.0 | -0.1 | -0.3 | -0.7 |
| Differenza rispetto al placebo (media aggiustata) | - | -0.8* | -0.9* | -1.1* | -1.5* |
| % di pazienti con 0.7 ¥ 0,7% in diminuzione rispetto al basale | 9% | 28% | 29% | 39% | 54% |
| * p <0,0001 rispetto al placebo. |
Quando somministrato alla stessa dose giornaliera totale, AVANDIA era generalmente più efficace nel ridurre FPG e HbA1c quando somministrato in dosi divise due volte al giorno rispetto a dosi una volta al giorno. Tuttavia, per HbA1c, la differenza tra le dosi di 4 mg una volta al giorno e 2 mg due volte al giorno non era statisticamente significativa.
Studi clinici a lungo termine
Il mantenimento a lungo termine dell'effetto è stato valutato in uno studio di 52 settimane, in doppio cieco, controllato con glyburide in pazienti con diabete di tipo 2. I pazienti sono stati randomizzati al trattamento con AVANDIA 2 mg due volte al giorno (N = 195) o AVANDIA 4 mg due volte al giorno (N = 189) o glyburide (N = 202) per 52 settimane. Ai pazienti in trattamento con glyburide è stato somministrato un dosaggio iniziale di 2,5 mg / die o 5,0 mg / die. Il dosaggio è stato quindi titolato con incrementi di 2,5 mg / die nelle successive 12 settimane, fino a un dosaggio massimo di 15,0 mg / die al fine di ottimizzare il controllo glicemico. Successivamente, la dose di gliburide è stata mantenuta costante.
La dose mediana titolata di gliburide è stata di 7,5 mg. Tutti i trattamenti hanno comportato un miglioramento statisticamente significativo del controllo glicemico rispetto al basale (Figura 4 e Figura 5). Alla fine della settimana 52, la riduzione dal basale di FPG e HbA1c era di -40,8 mg / dL e -0,53% con AVANDIA 4 mg due volte al giorno; -25,4 mg / dL e -0,27% con AVANDIA 2 mg due volte al giorno; e -30,0 mg / dL e -0,72% con glyburide. Per HbA1c, la differenza tra AVANDIA 4 mg due volte al giorno e gliburide non era statisticamente significativa alla settimana 52. Il calo iniziale di FPG con glyburide è stato maggiore che con AVANDIA; tuttavia, questo effetto è stato meno duraturo nel tempo.
Il miglioramento del controllo glicemico osservato con AVANDIA 4 mg due volte al giorno alla settimana 26 è stato mantenuto fino alla settimana 52 dello studio.
Figura 4 FPG medio nel tempo in uno studio controllato con gliceride di 52 settimane
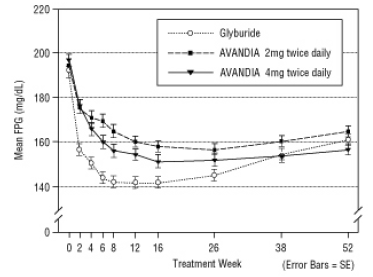
Figura 5 HbA1c medio nel tempo in uno studio controllato con gliceride di 52 settimane
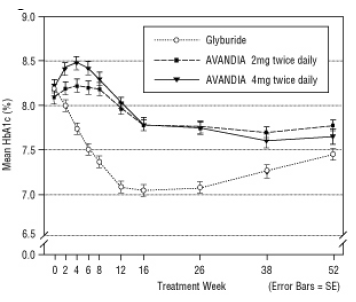
Ipoglicemia è stata segnalata nel 12,1% dei pazienti trattati con glyburide rispetto allo 0,5% (2 mg due volte al giorno) e all'1,6% (4 mg due volte al giorno) dei pazienti trattati con AVANDIA. I miglioramenti nel controllo glicemico sono stati associati ad un aumento di peso medio di 1,75 kg e 2,95 kg per pazienti trattati con 2 mg e 4 mg due volte al giorno di AVANDIA, rispettivamente, rispetto a 1,9 kg trattati con glyburide pazienti. Nei pazienti trattati con AVANDIA, i prodotti suddivisi con peptide C, insulina, pro-insulina e pro-insulina erano significativamente ridotto in maniera ordinata per dose, rispetto ad un aumento del trattamento con glyburide pazienti.
Uno studio sulla progressione del diabete (ADOPT) è stato uno studio multicentrico, in doppio cieco, controllato (N = 4.351) condotto tra 4 e 6 anni per confrontare la sicurezza e l'efficacia di AVANDIA, metformina e glyburide in monoterapia in pazienti recentemente diagnosticati con diabete mellito di tipo 2 (3 anni) non adeguatamente controllato con la dieta e esercizio. L'età media dei pazienti in questo studio era di 57 anni e la maggior parte dei pazienti (83%) non aveva una storia nota di malattie cardiovascolari. L'FPG basale medio e l'HbA1c erano rispettivamente di 152 mg / dL e del 7,4%. I pazienti sono stati randomizzati a ricevere AVANDIA 4 mg una volta al giorno, glyburide 2,5 mg una volta al giorno o metformina 500 mg una volta al giorno e le dosi erano titolato a un controllo glicemico ottimale fino a un massimo di 4 mg due volte al giorno per AVANDIA, 7,5 mg due volte al giorno per glyburide e 1.000 mg due volte al giorno per metformina. L'outcome primario di efficacia era il tempo per un FPG consecutivo> 180 mg / dL dopo almeno 6 settimane di trattamento al massimo dose tollerata del farmaco in studio o tempo per inadeguato controllo glicemico, come determinato da un giudizio indipendente Comitato.
L'incidenza cumulativa dell'outcome primario di efficacia a 5 anni è stata del 15% con AVANDIA, del 21% con metformina e del 34% con glyburide (hazard ratio 0,68 [IC 95% 0,55, 0,85] contro metformina, HR 0,37 [IC 95% 0,30, 0,45] rispetto a glyburide).
I dati sugli eventi cardiovascolari e sugli eventi avversi (inclusi gli effetti sul peso corporeo e sulla frattura ossea) di ADOPT per AVANDIA, metformina e gliburide sono descritti in AVVERTENZE E PRECAUZIONI e REAZIONI AVVERSE, rispettivamente. Come per tutti i farmaci, i risultati di efficacia devono essere considerati insieme alle informazioni sulla sicurezza per valutare i potenziali benefici e rischi per un singolo paziente.
Combinazione con metformina o sulfonilurea
L'aggiunta di AVANDIA alla metformina o alla sulfonilurea ha comportato riduzioni significative dell'iperglicemia rispetto a uno solo di questi due agenti. Questi risultati sono coerenti con un effetto additivo sul controllo glicemico quando AVANDIA è usato come terapia di combinazione.
Combinazione con metformina
Un totale di 670 pazienti con diabete di tipo 2 hanno partecipato a due 26 settimane, randomizzati, in doppio cieco, studi controllati con placebo / attivi progettati per valutare l'efficacia di AVANDIA in associazione con metformina. AVANDIA, somministrato in regime di dosaggio una volta al giorno o due volte al giorno, è stato aggiunto alla terapia di pazienti che non erano adeguatamente controllati alla dose massima (2,5 grammi / giorno) di metformina.
In uno studio, i pazienti non sono stati adeguatamente controllati con 2,5 grammi / die di metformina (FPG basale medio 216 mg / dL e basale medio HbA1c 8,8%) sono stati randomizzati a ricevere 4 mg di AVANDIA una volta al giorno, 8 mg di AVANDIA una volta al giorno o placebo in aggiunta a metformina. Un miglioramento statisticamente significativo di FPG e HbA1c è stato osservato in pazienti trattati con le combinazioni di metformina e 4 mg di AVANDIA una volta al giorno e 8 mg di AVANDIA una volta al giorno, rispetto ai pazienti hanno continuato con la sola metformina (Tabella 10).
Tabella 10 Parametri glicemici in uno studio di combinazione di 26 settimane di AVANDIA Plus Metformin
| Metformina N = 113 |
AVANDIA 4 mg una volta al giorno + metformina N = 116 |
AVANDIA 8 mg una volta al giorno + metformina N = 110 |
|
| FPG (mg / dL) | |||
| Linea di base (media) | 214 | 215 | 220 |
| Variazione rispetto al basale (media) | 6 | -33 | -48 |
| Differenza rispetto alla sola metformina (media corretta) | - | -40* | -53* |
| % di pazienti con ‰ ¥ 30 mg / dL diminuisce rispetto al basale | 20% | 45% | 61% |
| HbA1c (%) | |||
| Linea di base (media) | 8.6 | 8.9 | 8.9 |
| Variazione rispetto al basale (media) | 0.5 | -0.6 | -0.8 |
| Differenza rispetto alla sola metformina (media corretta) | - | -1.0* | -1.2* |
| % di pazienti con 0.7 ¥ 0,7% in diminuzione rispetto al basale | 11% | 45% | 52% |
| * p <0,0001 rispetto alla metformina. |
In un secondo studio di 26 settimane, i pazienti con diabete di tipo 2 non sono stati adeguatamente controllati con 2,5 grammi / die di metformina che sono stati randomizzati a ricevere la combinazione di AVANDIA 4 mg due volte al giorno e la metformina (N = 105) ha mostrato un miglioramento statisticamente significativo nel controllo glicemico con un effetto di trattamento medio per FPG di -56 mg / dL e un effetto di trattamento medio per HbA1c di -0,8% in più solo metformina. La combinazione di metformina e AVANDIA ha portato a livelli più bassi di FPG e HbA1c rispetto a entrambi i singoli agenti.
Pazienti che non erano adeguatamente controllati con una dose massima (2,5 grammi / giorno) di metformina e che lo erano il passaggio alla monoterapia con AVANDIA ha dimostrato la perdita di controllo glicemico, come evidenziato dagli aumenti del FPG e HbA1c. In questo gruppo sono stati osservati anche aumenti di LDL e VLDL.
Combinazione con una sulfonilurea
Un totale di 3.457 pazienti con diabete di tipo 2 hanno partecipato a dieci studi randomizzati, in doppio cieco, controllati con placebo / attivi da 24 a 26 settimane e uno Studio di 2 anni in doppio cieco, a controllo attivo su pazienti anziani, progettato per valutare l'efficacia e la sicurezza di AVANDIA in associazione con un sulfonilurea. AVANDIA 2 mg, 4 mg o 8 mg al giorno sono stati somministrati, una volta al giorno (3 studi) o in dosi divise due volte al giorno (7 studi), a pazienti non adeguatamente controllati con una dose submassimale o massima di sulfonilurea.
In questi studi, la combinazione di AVANDIA 4 mg o 8 mg al giorno (somministrata in dosi singole o due volte al giorno divise) e una la sulfonilurea ha ridotto significativamente FPG e HbA1c rispetto al placebo più la sulfonilurea o un'ulteriore titolazione del sulfonilurea. La Tabella 11 mostra i dati aggregati per 8 studi in cui AVANDIA aggiunto alla sulfonilurea è stato confrontato con il placebo più la sulfonilurea.
Tabella 11 Parametri glicemici in studi combinati da 24 a 26 settimane di AVANDIA Plus Sulfonylurea
| Dosaggio diviso due volte al giorno (5 studi) | sulfonilurea N = 397 |
AVANDIA 2 mg due volte al giorno + sulfonilurea N = 497 |
sulfonilurea N = 248 |
AVANDIA 4 mg due volte al giorno + sulfonilurea N = 346 |
| FPG (mg / dL) | ||||
| Linea di base (media) | 204 | 198 | 188 | 187 |
| Variazione rispetto al basale (media) | 11 | -29 | 8 | -43 |
| Differenza dalla sola sulfonilurea (media aggiustata) | - | -42* | - | -53* |
| % di pazienti con ‰ ¥ 30 mg / dL diminuisce rispetto al basale | 17% | 49% | 15% | 61% |
| HbA1c (%) | ||||
| Linea di base (media) | 9.4 | 9.5 | 9.3 | 9.6 |
| Variazione rispetto al basale (media) | 0.2 | -1.0 | 0.0 | -1.6 |
| Differenza dalla sola sulfonilurea (media aggiustata) | - | -1.1* | - | -1.4* |
| % di pazienti con 0.7 ¥ 0,7% in diminuzione rispetto al basale | 21% | 60% | 23% | 75% |
| Dosaggio giornaliero (3 studi) | sulfonilurea N = 172 |
AVANDIA 4 mg una volta al giorno + sulfonilurea N = 172 |
sulfonilurea N = 173 |
AVANDIA 8 mg una volta al giorno + sulfonilurea N = 176 |
| FPG (mg / dL) | ||||
| Linea di base (media) | 198 | 206 | 188 | 192 |
| Variazione rispetto al basale (media) | 17 | -25 | 17 | -43 |
| Differenza dalla sola sulfonilurea (media aggiustata) | - | -47* | - | -66* |
| % di pazienti con ‰ ¥ 30 mg / dL diminuisce rispetto al basale | 17% | 48% | 19% | 55% |
| HbA1c (%) | ||||
| Linea di base (media) | 8.6 | 8.8 | 8.9 | 8.9 |
| Variazione rispetto al basale (media) | 0.4 | -0.5 | 0.1 | -1.2 |
| Differenza dalla sola sulfonilurea (media aggiustata) | - | -0.9* | - | -1.4* |
| % di pazienti con 0.7 ¥ 0,7% in diminuzione rispetto al basale | 11% | 36% | 20% | 68% |
| * p <0,0001 rispetto alla sola solfonilurea. |
Uno degli studi di 24-26 settimane includeva pazienti che non erano adeguatamente controllati con dosi massime di gliburide e sono passati a 4 mg di AVANDIA al giorno in monoterapia; in questo gruppo, è stata dimostrata la perdita di controllo glicemico, come evidenziato dagli aumenti di FPG e HbA1c.
In uno studio di 2 anni in doppio cieco, i pazienti anziani (di età compresa tra 59 e 89 anni) con sulfonilurea semimassimale (glipizide 10 mg due volte al giorno) sono stati randomizzati a l'aggiunta di AVANDIA (n = 115, 4 mg una volta al giorno a 8 mg, se necessario) o al continuo aumento della titolazione di glipizide (n = 110), ad un massimo di 20 mg due volte quotidiano. FPG e HbA1c basali medi erano 157 mg / dL e 7,72%, rispettivamente, per il braccio AVANDIA plus glipizide e 159 mg / dL e 7,65%, rispettivamente, per il braccio glipizide up-titolazione. La perdita di controllo glicemico (FPG â ‰ ¥ 180 mg / dL) si è verificata in una proporzione significativamente più bassa di pazienti (2%) con AVANDIA più glipizide rispetto ai pazienti nel braccio con up-titolazione glipizide (28,7%). Circa il 78% dei pazienti in terapia di combinazione ha completato i 2 anni di terapia, mentre solo il 51% ha completato la monoterapia con glipizide. L'effetto della terapia di combinazione su FPG e HbA1c è stato duraturo nel periodo di studio di 2 anni, con i pazienti raggiungere una media di 132 mg / dL per FPG e una media del 6,98% per HbA1c rispetto a nessun cambiamento sulla glipizide braccio.
Combinazione con solfonilurea Plus metformina
In due studi da 24 a 26 settimane, in doppio cieco, controllati con placebo, progettati per valutare l'efficacia e la sicurezza di AVANDIA in associazione con sulfonilurea più metformina, AVANDIA 4 mg o 8 mg quotidianamente, è stato somministrato in dosi divise due volte al giorno, a pazienti non adeguatamente controllati con dosi submassimali (10 mg) e massime (20 mg) di gliburide e dose massima di metformina (2 Buongiorno). Un miglioramento statisticamente significativo di FPG e HbA1c è stato osservato in pazienti trattati con le combinazioni di sulfonilurea più metformina e 4 mg di AVANDIA e 8 mg di AVANDIA rispetto ai pazienti hanno continuato con la sulfonilurea più metformina, come mostrato nella Tabella 12.
Tabella 12 Parametri glicemici in uno studio di combinazione di 26 settimane di AVANDIA Plus sulfonilurea e metformina
| Solfonilurea + metformina N = 273 |
AVANDIA 2 mg due volte quotidiano + sulfonilurea + metformina N = 276 |
AVANDIA 4 mg due volte al giorno + sulfonilurea + metformina N = 277 |
|
| FPG (mg / dL) | |||
| Linea di base (media) | 189 | 190 | 192 |
| Variazione rispetto al basale (media) | 14 | -19 | -40 |
| Differenza dalla sulfonilurea più metformina (media aggiustata) | - | -30* | -52* |
| % di pazienti con ‰ ¥ 30 mg / dL diminuisce rispetto al basale | 16% | 46% | 62% |
| HbA1c (%) | |||
| Linea di base (media) | 8.7 | 8.6 | 8.7 |
| Variazione rispetto al basale (media) | 0.2 | -0.4 | -0.9 |
| Differenza dalla sulfonilurea più metformina (media aggiustata) | - | -0.6* | -1.1* |
| % di pazienti con 0.7 ¥ 0,7% in diminuzione rispetto al basale | 16% | 39% | 63% |
| * p <0,0001 rispetto al placebo. |
superiore
Riferimenti
- Documento informativo sulla Food and Drug Administration. Riunione congiunta dei comitati consultivi Endocrino Metabolic Drugs and Drug Safety and Risk Management. Ju 2007.
- Investigatori di prove DREAM. Effetto del rosiglitazone sulla frequenza del diabete con alterata tolleranza al glucosio o alterata glicemia a digiuno: un controllo randomizzato Lancetta 2006;368:1096-1105.
- Home PD, Pocock SJ, Beck-Nielsen H, et al. Il rosiglitazone ha valutato gli esiti di cardiova - un'analisi intermedia. NEJM 2007; 357: 1-11.
- Park JY, Kim KA, Kang MH, et al. Effetto della rifampicina sulla farmacocinetica del rosiglitazone in soggetti sani. Clin Pharmacol Ther 2004; 75: 157-162.
superiore
Come fornito / Conservazione e gestione
Ogni compressa pentagonale di TILTAB rivestita con film contiene rosiglitazone come maleato come segue: 2 mg-rosa, con impresso SB su un lato e 2 sull'altro; 4 mg-arancio, impresso con SB da un lato e 4 dall'altro; 8 mg-rosso-marrone, impresso con SB da un lato e 8 dall'altro.
- Flaconi da 2 mg da 60: NDC 0029-3158-18
- Flaconi da 4 mg da 30: NDC 0029-3159-13
- Flaconi da 4 mg da 90: NDC 0029-3159-00
- Flaconi da 8 mg da 30: NDC 0029-3160-13
- Flaconi da 8 mg da 90: NDC 0029-3160-59
Conservare a 25 ° C (77 ° F); escursioni da 15 a 30 C (da 59 a 86 F). Distribuire in un contenitore stretto e resistente alla luce.
ultimo aggiornamento 02/2008
Avandia, rosiglitazone maleato, informazioni per il paziente (in inglese semplice)
Informazioni dettagliate su segni, sintomi, cause, trattamenti del diabete
Le informazioni contenute in questa monografia non intendono coprire tutti i possibili usi, indicazioni, precauzioni, interazioni farmacologiche o effetti avversi. Questa informazione è generalizzata e non è intesa come consulenza medica specifica. Se ha domande sui medicinali che sta assumendo o desidera ulteriori informazioni, consultare il medico, il farmacista o l'infermiere.
torna a:Sfoglia tutti i farmaci per il diabete

