Apidra per il trattamento del diabete
Marchio: Apidra
Nome generico: insulina glulisina
Apidra (insulina glulisine) è un prodotto artificiale quasi identico all'insulina umana. È usato per trattare il diabete mellito. Uso, dosaggio, effetti collaterali.
Contenuti:
Indicazioni e utilizzo
Dosaggio e amministrazione
Controindicazioni
Avvertenze e precauzioni
Reazioni avverse
Interazioni farmacologiche
Utilizzare in popolazioni specifiche
sovradosaggio
Descrizione
Farmacologia clinica
Tossicologia non clinica
Studi clinici
Come fornito
Apidra, insulina glusina, informazioni per il paziente (in inglese semplice)
indicazioni
Apidra è un analogo dell'insulina umana ad azione rapida indicato per migliorare il controllo glicemico negli adulti e nei bambini con diabete mellito.
superiore
Dosaggio e amministrazione
Considerazioni sul dosaggio
APIDRA è un analogo dell'insulina ricombinante che è equipotente all'insulina umana (ovvero un'unità di APIDRA ha lo stesso effetto ipoglicemizzante di un'unità dell'insulina umana normale) se somministrata per via endovenosa. Quando somministrato per via sottocutanea, APIDRA ha un inizio d'azione più rapido e una durata d'azione più breve rispetto all'insulina umana normale.
Il dosaggio di APIDRA deve essere personalizzato. Il monitoraggio della glicemia è essenziale in tutti i pazienti in terapia con insulina.
Il fabbisogno giornaliero totale di insulina può variare ed è generalmente compreso tra 0,5 e 1 unità / kg / giorno. Il fabbisogno di insulina può essere modificato durante lo stress, la malattia maggiore o con cambiamenti nell'esercizio fisico, nei modelli di pasto o nei farmaci somministrati in associazione.
Amministrazione sottocutanea
APIDRA deve essere somministrato entro 15 minuti prima di un pasto o entro 20 minuti dopo l'inizio di un pasto.
APIDRA somministrato per iniezione sottocutanea deve generalmente essere usato in regimi con insulina ad azione intermedia o prolungata.
APIDRA deve essere somministrato mediante iniezione sottocutanea nella parete addominale, nella coscia o nella parte superiore del braccio. I siti di iniezione devono essere ruotati all'interno della stessa regione (addome, coscia o parte superiore del braccio) da un'iniezione all'altra per ridurre il rischio di lipodistrofia [Vedi REAZIONI AVVERSE].
Infusione sottocutanea continua (pompa per insulina)
APIDRA può essere somministrato mediante infusione sottocutanea continua nella parete addominale. Non utilizzare insuline diluite o miscelate in pompe per insulina esterne. I siti di infusione devono essere ruotati all'interno della stessa regione per ridurre il rischio di lipodistrofia [Vedi REAZIONI AVVERSE]. La programmazione iniziale della pompa per infusione di insulina esterna dovrebbe basarsi sulla dose totale giornaliera di insulina del regime precedente.
Le seguenti pompe di insulina sono state utilizzate negli studi clinici APIDRA condotti da sanofi-aventis, il produttore di APIDRA:
- Disetronic® H-Tron® plus V100 e D-Tron® con cateteri Disetronic (Rapid ™, Rapid C ™, Rapid D ™ e Tender ™)
- Modelli MiniMed® 506, 507, 507c e 508 con cateteri MiniMed (Sof-set Ultimate QR ™ e Quick-set ™).
Prima di utilizzare una pompa per insulina diversa con APIDRA, leggere l'etichetta della pompa per assicurarsi che la pompa sia stata valutata con APIDRA.
I medici e i pazienti devono valutare attentamente le informazioni sull'uso della pompa nelle informazioni sulla prescrizione APIDRA, nel foglio illustrativo per il paziente e nel manuale del produttore della pompa. Le informazioni specifiche di APIDRA devono essere seguite per il tempo di utilizzo, la frequenza di cambio dei set di infusione o altro dettagli specifici sull'uso di APIDRA, poiché le informazioni specifiche di APIDRA possono differire dal manuale generale della pompa Istruzioni.
Sulla base di studi in vitro che hanno mostrato perdita del conservante, metacresolo e degradazione dell'insulina, APIDRA nel serbatoio deve essere cambiato almeno ogni 48 ore. APIDRA in uso clinico non deve essere esposto a temperature superiori a 37,6 ° F (37,6 ° F). [Vedere AVVERTENZE E PRECAUZIONI e COME FORNITO / Conservazione e gestione].
Amministrazione endovenosa
APIDRA può essere somministrato per via endovenosa sotto controllo medico per il controllo glicemico con un attento monitoraggio della glicemia e del potassio sierico per evitare ipoglicemia e ipopotassiemia. Per uso endovenoso, APIDRA deve essere usato a concentrazioni da 0,05 Unità / mL a 1 Unità / mL di insulina glulisina nei sistemi di infusione utilizzando sacche di polivinilcloruro (PVC). APIDRA ha dimostrato di essere stabile solo nella normale soluzione salina (cloruro di sodio allo 0,9%). I medicinali per uso parenterale devono essere ispezionati visivamente per verificare la presenza di particelle e scolorimento prima della somministrazione, ogni volta che la soluzione e il contenitore lo consentono. Non somministrare miscele di insulina per via endovenosa.
Forme di dosaggio e punti di forza
Apidra 100 unità per ml (U-100) è disponibile come:
- Flaconcini da 10 ml
- Cartucce da 3 mL da utilizzare in OptiClik® Dispositivo di erogazione dell'insulina
- Penna preriempita SoloStar da 3 ml
superiore
Controindicazioni
Apidra è controindicato:
- durante episodi di ipoglicemia
- in pazienti ipersensibili ad Apidra o ad uno qualsiasi dei suoi eccipienti
Se usati in pazienti con ipersensibilità nota ad Apidra o ai suoi eccipienti, i pazienti possono sviluppare reazioni di ipersensibilità localizzate o generalizzate [Vedi Reazioni avverse].
superiore
Avvertenze e precauzioni
Regolazione e monitoraggio del dosaggio
Il monitoraggio del glucosio è essenziale per i pazienti in terapia con insulina. Le modifiche a un regime di insulina devono essere effettuate con cautela e solo sotto controllo medico. Cambiamenti nella concentrazione di insulina, produttore, tipo o metodo di somministrazione possono comportare la necessità di un cambiamento nella dose di insulina. Potrebbe essere necessario modificare il trattamento antidiabetico orale concomitante.
Come con tutte le preparazioni di insulina, il corso d'azione di Apidra può variare in soggetti diversi o in momenti diversi lo stesso individuo e dipende da molte condizioni, incluso il sito di iniezione, l'afflusso di sangue locale o locale temperatura. I pazienti che modificano il livello di attività fisica o il piano alimentare possono richiedere un aggiustamento dei dosaggi di insulina.
L'ipoglicemia
L'ipoglicemia è la reazione avversa più comune della terapia insulinica, incluso Apidra. Il rischio di ipoglicemia aumenta con un controllo glicemico più stretto. I pazienti devono essere educati a riconoscere e gestire l'ipoglicemia. Una grave ipoglicemia può portare a perdita di coscienza e / o convulsioni e può provocare una compromissione temporanea o permanente della funzione cerebrale o della morte. Ipoglicemia grave che richiede l'assistenza di un'altra persona e / o infusione di glucosio parenterale o la somministrazione di glucagone è stata osservata in studi clinici con insulina, inclusi studi con Apidra.
I tempi dell'ipoglicemia di solito riflettono il profilo tempo-azione delle formulazioni di insulina somministrate. Altri fattori come i cambiamenti nell'assunzione di cibo (ad es. Quantità di cibo o tempi dei pasti), sito di iniezione, esercizio fisico e farmaci concomitanti possono anche alterare il rischio di ipoglicemia [Vedi Interazioni farmacologiche].
Come con tutte le insuline, usare cautela nei pazienti con consapevolezza di ipoglicemia e nei pazienti che potrebbero esserlo predisposto all'ipoglicemia (ad esempio, la popolazione pediatrica e i pazienti che digiunano o hanno cibo irregolare l'assunzione). La capacità del paziente di concentrarsi e reagire può essere compromessa dall'ipoglicemia. Ciò può presentare un rischio in situazioni in cui queste abilità sono particolarmente importanti, come guidare o usare altri macchinari.
I rapidi cambiamenti nei livelli sierici di glucosio possono indurre sintomi simili all'ipoglicemia nelle persone con diabete, indipendentemente dal valore del glucosio. I sintomi di allarme precoce dell'ipoglicemia possono essere diversi o meno pronunciati in determinate condizioni, come il diabete di lunga data, le malattie dei nervi diabetici, l'uso di farmaci come i beta-bloccanti [Vedi Interazioni farmacologiche] o intensificato controllo del diabete. Queste situazioni possono causare grave ipoglicemia (e, possibilmente, perdita di coscienza) prima della consapevolezza del paziente dell'ipoglicemia.
L'insulina somministrata per via endovenosa ha un inizio d'azione più rapido rispetto all'insulina somministrata per via sottocutanea, che richiede un monitoraggio più attento dell'ipoglicemia.
Ipersensibilità e reazioni allergiche
Un'allergia grave, pericolosa per la vita, generalizzata, inclusa l'anafilassi, può verificarsi con prodotti insulinici, tra cui Apidra [Vedi Reazioni avverse].
ipokaliemia
Tutti i prodotti insulinici, incluso Apidra, causano uno spostamento del potassio dallo spazio extracellulare a quello intracellulare, portando probabilmente all'ipopotassiemia. L'ipopotassiemia non trattata può causare paralisi respiratoria, aritmia ventricolare e morte. Usare cautela nei pazienti che possono essere a rischio di ipopotassiemia (ad es. Pazienti che assumono farmaci per abbassare il potassio, pazienti che assumono farmaci sensibili alle concentrazioni sieriche di potassio). Monitorare frequentemente glucosio e potassio quando Apidra viene somministrato per via endovenosa.
Insufficienza renale o epatica
Nei pazienti con insufficienza renale o epatica può essere necessario un frequente monitoraggio del glucosio e riduzione della dose di insulina [Vedi Farmacologia clinica].
Miscelazione di insuline
Apidra per iniezione sottocutanea non deve essere miscelato con preparati di insulina diversi dall'insulina NPH. Se Apidra viene miscelato con insulina NPH, Apidra deve essere prima aspirato nella siringa. L'iniezione dovrebbe avvenire immediatamente dopo la miscelazione.
Non mescolare Apidra con altre insuline per somministrazione endovenosa o per l'uso in una pompa per infusione sottocutanea continua.
Apidra per somministrazione endovenosa non deve essere diluito con soluzioni diverse dallo 0,9% di cloruro di sodio (soluzione fisiologica). Non sono state stabilite l'efficacia e la sicurezza della miscelazione di Apidra con diluenti o altre insuline per l'uso in pompe esterne per infusione sottocutanea.
Pompe per infusione di insulina sottocutanea
Se utilizzato in una pompa per insulina esterna per infusione sottocutanea, Apidra non deve essere diluito o miscelato con nessun'altra insulina. Gli apidra nel serbatoio devono essere cambiati almeno ogni 48 ore. Apidra non deve essere esposto a temperature superiori a 98,6 ° F (37 ° C).
Il malfunzionamento della pompa per insulina o del set per infusione o la degradazione dell'insulina possono portare rapidamente a iperglicemia e chetosi. È necessaria una rapida identificazione e correzione della causa dell'iperglicemia o della chetosi. Potrebbero essere necessarie iniezioni sottocutanee provvisorie con Apidra. I pazienti che usano la terapia continua con pompa per infusione sottocutanea di insulina devono essere addestrati a somministrare insulina per iniezione e devono disporre di terapia insulinica alternativa in caso di guasto della pompa. [Vedere Dosaggio e amministrazione, Come fornito / Conservazione e gestione].
Amministrazione endovenosa
Quando Apidra viene somministrato per via endovenosa, i livelli di glucosio e potassio devono essere attentamente monitorati per evitare ipoglicemia e ipopotassiemia potenzialmente fatali.
Non mescolare Apidra con altre insuline per somministrazione endovenosa. Apidra può essere diluito solo in una normale soluzione salina.
Interazioni farmacologiche
Alcuni farmaci possono alterare il fabbisogno di insulina e il rischio di ipoglicemia o iperglicemia [Vedi Interazioni farmacologiche].
superiore
Reazioni avverse
Le seguenti reazioni avverse sono discusse altrove:
- Ipoglicemia [Vedi Avvertenze e precauzioni]
- Ipopotassiemia [Vedi Avvertenze e precauzioni]
Esperienza di sperimentazione clinica
Poiché gli studi clinici sono condotti secondo modelli molto diversi, le percentuali di reazioni avverse riportate in uno studio clinico potrebbero non esserlo può essere facilmente confrontato con i tassi riportati in un altro studio clinico e potrebbe non riflettere i tassi effettivamente osservati in ambito clinico pratica.
Le frequenze delle reazioni avverse da farmaco durante gli studi clinici su Apidra in pazienti con diabete mellito di tipo 1 e diabete mellito di tipo 2 sono elencate nelle tabelle seguenti.
Tabella 1: Eventi avversi emergenti dal trattamento in studi aggregati su adulti con diabete di tipo 1 (eventi avversi con frequenza 5 ¥ 5%)
| APIDRA,% (N = 950) |
Tutti i comparatoriun', % (N = 641) |
|
| nasofaringite | 10.6 | 12.9 |
| L'ipoglicemiaB | 6.8 | 6.7 |
| Infezione del tratto respiratorio superiore | 6.6 | 5.6 |
| Influenza | 4.0 | 5.0 |
|
un' Insulina lispro, insulina umana regolare, insulina aspart B Solo grave ipoglicemia sintomatica |
Tabella 2: Eventi avversi emergenti dal trattamento in studi aggregati su adulti con diabete di tipo 2 (eventi avversi con frequenza 5 ¥ 5%)
| APIDRA,% (N = 883) |
Insulina umana regolare,% (N = 883) |
|
| Infezione del tratto respiratorio superiore | 10.5 | 7.7 |
| nasofaringite | 7.6 | 8.2 |
| Edema periferico | 7.5 | 7.8 |
| Influenza | 6.2 | 4.2 |
| artralgia | 5.9 | 6.3 |
| Ipertensione | 3.9 | 5. |
- Pediatria
La tabella 3 riassume le reazioni avverse che si verificano con una frequenza superiore al 5% in uno studio clinico in bambini e adolescenti con diabete di tipo 1 trattati con APIDRA (n = 277) o insulina lispro (N = 295).
Tabella 3: Terapia-eventi avversi emergenti in bambini e adolescenti con diabete di tipo 1 (reazioni avverse con frequenza â ¥ 5%)
| APIDRA,% (N = 277) |
Lispro,% (N = 295) |
|
| nasofaringite | 9.0 | 9.5 |
| Infezione del tratto respiratorio superiore | 8.3 | 10.8 |
| Mal di testa | 6.9 | 11.2 |
| Sequestro ipoglicemico | 6.1 | 4.7 |
- Grave ipoglicemia sintomatica
L'ipoglicemia è la reazione avversa più comunemente osservata nei pazienti che usano insulina, incluso Apidra [Vedi Avvertenze e precauzioni]. I tassi e l'incidenza di grave ipoglicemia sintomatica, definita come ipoglicemia che richiede un intervento da parte di terzi, erano comparabili per tutti i regimi di trattamento (vedere Tabella 4). Nello studio clinico di fase 3, i bambini e gli adolescenti con diabete di tipo 1 hanno avuto un'incidenza più elevata di grave ipoglicemia sintomatica nei due gruppi di trattamento rispetto agli adulti di tipo 1 diabete. (vedi tabella 4) [Vedi Studi clinici].
Tabella 4: Ipoglicemia sintomatica grave *
| Diabete di tipo 1 adulti 12 settimane con insulina glargine |
Tipo 1 adulti del diabete 26 settimane con insulina glargine |
Diabete di tipo 2 adulti 26 settimane con insulina umana NPH |
Pediatria del diabete di tipo 1 26 settimane |
||||||
|---|---|---|---|---|---|---|---|---|---|
| Apidra Pre-pasto |
Apidra Post-pasto |
Insulina umana regolare | Apidra | Insulina Lispro | Apidra | Insulina umana regolare | Apidra | Insulina Lispr | |
| * Grave ipoglicemia sintomatica definita come evento ipoglicemico che richiede l'assistenza di un'altra persona che ha soddisfatto uno dei seguenti criteri: l'evento è stato associato ad una glicemia riferita a sangue intero <36 mg / dL o l'evento è stato associato a un rapido recupero dopo somministrazione orale di carboidrati, glucosio per via endovenosa o glucagone. | |||||||||
| Eventi al mese per paziente | 0.05 | 0.05 | 0.13 | 0.02 | 0.02 | 0.00 | 0.00 | 0.09 | 0.08 |
| Percentuale di pazienti (n / N totale) | 8.4% (24/286) | 8.4% (25/296) | 10.1% (28/278) | 4.8% (16/339) |
4.0% (13/333) |
1.4% (6/416) |
1.2% (5/420) |
16.2% (45/277) |
19.3% (57/295) |
- Inizio dell'insulina e intensificazione del controllo del glucosio
L'intensificazione o il rapido miglioramento del controllo del glucosio è stato associato a un transitorio, reversibile disturbo della rifrazione oftalmologica, peggioramento della retinopatia diabetica e dolore periferico acuto neuropatia. Tuttavia, il controllo glicemico a lungo termine riduce il rischio di retinopatia diabetica e neuropatia.
- lipodistrofia
L'uso a lungo termine di insulina, incluso Apidra, può causare lipodistrofia nel sito di iniezioni o infusioni ripetute di insulina. La lipodistrofia comprende lipoipertrofia (ispessimento del tessuto adiposo) e lipoatrofia (assottigliamento del tessuto adiposo) e può influenzare l'assorbimento di insulina. Ruotare i siti di iniezione o infusione di insulina nella stessa regione per ridurre il rischio di lipodistrofia. [Vedere Dosaggio e amministrazione].
- Aumento di peso
L'aumento di peso può verificarsi con la terapia insulinica, incluso Apidra, ed è stato attribuito agli effetti anabolici dell'insulina e alla riduzione della glucosuria.
- Edema periferico
L'insulina, incluso Apidra, può causare ritenzione di sodio ed edema, in particolare se un controllo metabolico precedentemente scarso è migliorato dall'intensificazione della terapia insulinica.
- Reazioni avverse con infusione di insulina sottocutanea continua (CSII)
In uno studio randomizzato di 12 settimane in pazienti con diabete di tipo 1 (n = 59), i tassi di catetere le occlusioni e le reazioni al sito di infusione erano simili per i pazienti trattati con Apidra e insulina aspart (Tabella 5).
Tabella 5: Occlusioni di catetere e reazioni nel sito di infusione.
| Apidra (N = 29) |
insulina aspart (N = 30) |
|
|---|---|---|
| Occlusioni di catetere / mese | 0.08 | 0.15 |
| Reazioni al sito di infusione | 10.3% (3/29) | 13.3% (4/30) |
- Reazioni allergiche
Allergia locale
Come con qualsiasi terapia insulinica, i pazienti che assumono Apidra possono manifestare arrossamento, gonfiore o prurito nel sito di iniezione. Queste reazioni minori di solito si risolvono in pochi giorni o alcune settimane, ma in alcune occasioni può richiedere l'interruzione di Apidra. In alcuni casi, queste reazioni possono essere correlate a fattori diversi dall'insulina, come irritanti in un detergente per la pelle o scarsa tecnica di iniezione.
Allergia sistemica
Un'allergia grave, pericolosa per la vita, generalizzata, inclusa l'anafilassi, può verificarsi con qualsiasi insulina, inclusa Apidra. L'allergia generalizzata all'insulina può causare eruzioni cutanee su tutto il corpo (incluso prurito), dispnea, respiro sibilante, ipotensione, tachicardia o diaforesi.
In studi clinici controllati fino a 12 mesi di durata, sono state segnalate potenziali reazioni allergiche sistemiche in 79 pazienti 1833 pazienti (4,3%) che hanno ricevuto Apidra e 58 su 1524 pazienti (3,8%) che hanno ricevuto il comparatore a breve durata d'azione insuline. Durante questi studi il trattamento con Apidra è stato definitivamente sospeso in 1 su 1833 pazienti a causa di una potenziale reazione allergica sistemica.
Reazioni localizzate e mialgie generalizzate sono state riportate con l'uso di metacresol, che è un eccipiente di Apidra.
Produzione di anticorpi
In uno studio su pazienti con diabete di tipo 1 (n = 333), le concentrazioni di anticorpi anti-insulina che reagiscono con l'insulina umana e l'insulina la glulisina (anticorpi insulino-reattivi) è rimasta vicino al basale durante i primi 6 mesi dello studio nei pazienti trattati con Apidra. È stata osservata una diminuzione della concentrazione di anticorpi durante i 6 mesi successivi dello studio. In uno studio su pazienti con diabete di tipo 2 (n = 411), un analogo aumento della concentrazione anticorpale insulinica reattiva era osservato nei pazienti trattati con Apidra e nei pazienti trattati con insulina umana durante i primi 9 mesi di studia. Successivamente la concentrazione di anticorpi è diminuita nei pazienti con Apidra e è rimasta stabile nei pazienti con insulina umana. Non c'era correlazione tra la concentrazione di anticorpi insulinici cross-reattivi e i cambiamenti di HbA1c, le dosi di insulina o l'incidenza di ipoglicemia. Il significato clinico di questi anticorpi non è noto.
Apidra non ha suscitato una risposta anticorpale significativa in uno studio su bambini e adolescenti con diabete di tipo 1.
Esperienza post-marketing
Le seguenti reazioni avverse sono state identificate durante l'uso post-approvazione di Apidra.
Poiché queste reazioni sono segnalate volontariamente da una popolazione di dimensioni incerte, non lo è sempre possibile stimare in modo affidabile la loro frequenza o stabilire una relazione causale con il farmaco esposizione.
Sono stati riportati errori terapeutici in cui altre insuline, in particolare insuline a lunga durata d'azione, sono state somministrate accidentalmente al posto di Apidra.
superiore
Interazioni farmacologiche
Numerosi farmaci influenzano il metabolismo del glucosio e possono richiedere un aggiustamento della dose di insulina e un monitoraggio particolarmente attento.
I farmaci che possono aumentare l'effetto ipoglicemizzante delle insuline, incluso Apidra, e quindi aumentare il rischio di ipoglicemia, includono prodotti antidiabetici orali, pramlintide, ACE-inibitori, disopiramide, fibrati, fluoxetina, inibitori delle monoaminoossidasi, propossifene, pentossifillina, salicilati, analoghi della somatostatina e sulfonamide antibiotici.
I farmaci che possono ridurre l'effetto ipoglicemizzante di Apidra includono corticosteroidi, niacina, danazolo, diuretici, agenti simpaticomimetici (ad es. Epinefrina, albuterolo, terbutalina), glucagone, isoniazide, derivati della fenotiazina, somatropina, ormoni tiroidei, estrogeni, progestinici (ad es. nei contraccettivi orali), inibitori della proteasi e atipici antipsicotici.
I beta-bloccanti, la clonidina, i sali di litio e l'alcol possono aumentare o ridurre l'effetto ipoglicemizzante dell'insulina.
La pentamidina può causare ipoglicemia, che a volte può essere seguita da iperglicemia.
I segni di ipoglicemia possono essere ridotti o assenti nei pazienti che assumono farmaci anti-adrenergici come beta-bloccanti, clonidina, guanetidina e reserpina.
superiore
Utilizzare in popolazioni specifiche
Gravidanza
Categoria di gravidanza C: studi di riproduzione e teratologia sono stati condotti con insulina glulisina in ratti e conigli usando insulina umana regolare come comparatore. L'insulina glulisina è stata somministrata alle femmine di ratto durante la gravidanza a dosi sottocutanee fino a 10 Unità / kg una volta al giorno (dose che determina esposizione 2 volte la dose media umana, basata sul confronto della superficie corporea) e non ha avuto effetti tossici significativi sull'embrione-fetale sviluppo.
L'insulina glulisina è stata somministrata a conigli femmine durante la gravidanza a dosi sottocutanee fino a 1,5 Unità / kg / giorno (dose risultante in un'esposizione 0,5 volte la dose media nell'uomo, in base alla superficie corporea confronto). Gli effetti avversi sullo sviluppo embrio-fetale sono stati osservati solo a livelli tossici materni che inducono ipoglicemia. È stata osservata una maggiore incidenza di perdite post-impianto e difetti scheletrici a un livello di dose di 1,5 Unità / kg una volta al giorno (dose con conseguente esposizione 0,5 volte la dose media umana, basata sul confronto della superficie corporea) che ha causato anche la mortalità in dighe. Una leggera aumento dell'incidenza delle perdite post-impianto è stata osservata al successivo livello di dose inferiore di 0,5 Unità / kg una volta al giorno (dose che determina un'esposizione 0,2 volte la dose media nell'uomo, in base al confronto della superficie corporea) che era anche associata a grave ipoglicemia, ma non c'erano difetti dose. Non sono stati osservati effetti nei conigli alla dose di 0,25 unità / kg una volta al giorno (dose che determina un'esposizione 0,1 volte la dose media umana, sulla base del confronto della superficie corporea). Gli effetti dell'insulina glulisina non differivano da quelli osservati con insulina umana regolare sottocutanea alle stesse dosi e sono stati attribuiti agli effetti secondari dell'ipoglicemia materna.
Non esistono studi clinici ben controllati sull'uso di Apidra in donne in gravidanza. Poiché gli studi sulla riproduzione animale non sono sempre predittivi della risposta umana, questo farmaco deve essere usato durante la gravidanza solo se il potenziale beneficio giustifica il potenziale rischio per il feto. È essenziale per i pazienti con diabete o con una storia di diabete gestazionale mantenere un buon controllo metabolico prima del concepimento e durante la gravidanza. Il fabbisogno di insulina può diminuire durante il primo trimestre, generalmente aumentare durante il secondo e il terzo trimestre e diminuire rapidamente dopo il parto. Un attento monitoraggio del controllo del glucosio è essenziale in questi pazienti.
Madri che allattano
Non è noto se l'insulina glulisina sia escreta nel latte materno. Poiché molti farmaci vengono escreti nel latte materno, si deve usare cautela quando Apidra viene somministrato a una donna che allatta. L'uso di Apidra è compatibile con l'allattamento al seno, ma le donne diabetiche che stanno allattando possono richiedere un aggiustamento delle dosi di insulina.
Uso pediatrico
La sicurezza e l'efficacia delle iniezioni sottocutanee di Apidra sono state stabilite in pazienti pediatrici (da 4 a 17 anni) con diabete di tipo 1 [Vedi Studi clinici]. Apidra non è stato studiato in pazienti pediatrici con diabete di tipo 1 di età inferiore ai 4 anni e in pazienti pediatrici con diabete di tipo 2.
Come negli adulti, il dosaggio di Apidra deve essere personalizzato nei pazienti pediatrici in base alle esigenze metaboliche e al frequente monitoraggio della glicemia.
Uso geriatrico
Negli studi clinici (n = 2408), Apidra è stato somministrato a 147 pazienti di età pari o superiore a 65 anni e 27 pazienti di età pari o superiore a 75 anni. La maggior parte di questo piccolo sottogruppo di pazienti anziani aveva il diabete di tipo 2. La variazione dei valori di HbA1c e delle frequenze di ipoglicemia non differiva in base all'età. Tuttavia, si deve usare cautela quando Apidra viene somministrato a pazienti geriatrici.
superiore
sovradosaggio
L'insulina in eccesso può causare ipoglicemia e, in particolare se somministrata per via endovenosa, ipopotassiemia. Lievi episodi di ipoglicemia di solito possono essere trattati con glucosio orale. Potrebbero essere necessari aggiustamenti del dosaggio del farmaco, dei modelli di pasto o dell'esercizio fisico. Episodi più gravi di ipoglicemia con coma, convulsioni o insufficienza neurologica possono essere trattati con glucagone intramuscolare / sottocutaneo o glucosio endovenoso concentrato. L'assunzione e l'osservazione sostenute di carboidrati possono essere necessarie perché l'ipoglicemia può ripresentarsi dopo un evidente recupero clinico. L'ipopotassiemia deve essere corretta in modo appropriato.
Descrizione
Apidra® (iniezione di insulina glulisina [origine rDNA]) è un analogo dell'insulina umana ad azione rapida utilizzato per ridurre la glicemia. L'insulina glulisina è prodotta con la tecnologia del DNA ricombinante utilizzando un ceppo di laboratorio non patogeno dell'Escherichia coli (K12). L'insulina glulisina differisce dall'insulina umana in quanto l'amminoacido asparagina in posizione B3 è sostituito dalla lisina e la lisina in posizione B29 è sostituita dall'acido glutammico. Chimicamente, l'insulina glulisina è insulina 3B-lisina-29B-acido glutammico-umano, ha la formula empirica C258H384N64O78S6 e un peso molecolare di 5823 e ha la seguente formula strutturale:

Apidra è una soluzione sterile, acquosa, trasparente e incolore. Ogni millilitro di Apidra contiene 100 unità (3,49 mg) di insulina glulisina, 3,15 mg di metacresolo, 6 mg di trometamina, 5 mg di cloruro di sodio, 0,01 mg di polisorbato 20 e acqua per preparazioni iniettabili. Apidra ha un pH di circa 7,3. Il pH viene regolato mediante aggiunta di soluzioni acquose di acido cloridrico e / o idrossido di sodio.
superiore
Farmacologia clinica
Meccanismo di azione
La regolazione del metabolismo del glucosio è l'attività primaria delle insuline e degli analoghi dell'insulina, inclusa l'insulina glulisina. Le insuline riducono la glicemia stimolando l'assorbimento periferico di glucosio da parte dei muscoli scheletrici e dei grassi e inibendo la produzione di glucosio epatico. Le insuline inibiscono la lipolisi e la proteolisi e migliorano la sintesi proteica.
Le attività ipoglicemizzanti di Apidra e dell'insulina umana regolare sono equipotenti se somministrate per via endovenosa. Dopo somministrazione sottocutanea, l'effetto di Apidra è più rapido nell'insorgenza e di durata inferiore rispetto all'insulina umana normale. [Vedi Farmacodinamica].
farmacodinamica
Studi condotti su volontari sani e pazienti con diabete hanno dimostrato che Apidra ha una maggiore rapidità inizio dell'azione e una durata più breve dell'attività rispetto alla normale insulina umana quando somministrata per via sottocutanea.
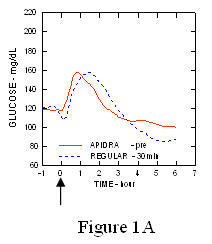
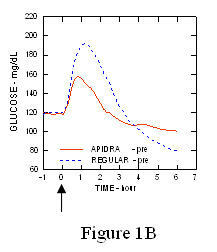
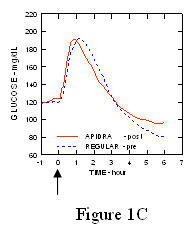
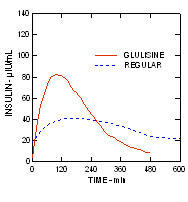
In uno studio su pazienti con diabete di tipo 1 (n = 20), i profili ipoglicemizzanti di Apidra e l'insulina umana regolare è stata valutata in vari momenti in relazione a un pasto standard alla dose di 0,15 Unità / kg. (Figura 1.)
L'escursione massima di glucosio nel sangue (Î ”GLUmax; concentrazione basale di glucosio sottratta) per Apidra iniettata 2 minuti prima di un pasto era di 65 mg / dL rispetto a 64 mg / dL per l'uomo normale insulina iniettata 30 minuti prima di un pasto (vedere la Figura 1A) e 84 mg / dL per insulina umana normale iniettata 2 minuti prima di un pasto (vedere la Figura 1B). L'escursione massima di glucosio nel sangue per Apidra iniettata 15 minuti dopo l'inizio di un pasto era di 85 mg / dL rispetto a 84 mg / dL per insulina umana normale iniettata 2 minuti prima di un pasto (vedere la Figura 1C).
Figura 1. Glicemia media seriale raccolta fino a 6 ore dopo una singola dose di Apidra e insulina umana regolare. Apidra somministrato 2 minuti (Apidra - pre) prima dell'inizio di un pasto rispetto all'insulina umana normale somministrata 30 minuti (Regolare - 30 min) prima dell'inizio del pasto (Figura 1A) e rispetto all'insulina umana normale (Regular - pre) somministrata 2 minuti prima di un pasto (Figura 1B). Apidra somministrato 15 minuti (Apidra - post) dopo l'inizio di un pasto rispetto all'insulina umana normale (Regular - pre) somministrata 2 minuti prima di un pasto (Figura 1C). Sull'asse x zero (0) è l'inizio di un pasto di 15 minuti.
 |
 |
 |
 |
In uno studio crossover bidirezionale randomizzato, in aperto, 16 soggetti maschi sani hanno ricevuto un trattamento endovenoso infusione di Apidra o di insulina umana regolare con diluente salino ad una velocità di 0,8 milli Unità / kg / min per due ore. L'infusione della stessa dose di Apidra o di insulina umana regolare ha prodotto un equivalente smaltimento del glucosio allo stato stazionario.
farmacocinetica
Assorbimento e biodisponibilità
I profili farmacocinetici in volontari sani e pazienti con diabete (tipo 1 o tipo 2) hanno dimostrato che l'assorbimento dell'insulina glulisina era più veloce di quello dell'insulina umana normale.
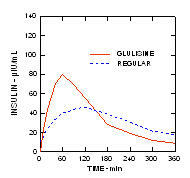
In uno studio su pazienti con diabete di tipo 1 (n = 20) dopo somministrazione sottocutanea di 0,15 unità / kg, il tempo mediano alla massima concentrazione (Tmax) era di 60 minuti (intervallo da 40 a 120 minuti) e la concentrazione di picco (Cmax) era di 83 microUnità / mL (intervallo da 40 a 131 microUnità / mL) per insulina glulisina rispetto a una Tmax mediana di 120 minuti (intervallo da 60 a 239 minuti) e una Cmax di 50 microUnità / mL (intervallo da 35 a 71 microUnità / mL) per l'uomo normale insulina. (Figura 2)
figura 2. Profili farmacocinetici di insulina glulisina e insulina umana regolare in pazienti con diabete di tipo 1 dopo una dose di 0,15 unità / kg.
L'insulina glulisina e l'insulina umana regolare sono state somministrate per via sottocutanea alla dose di 0,2 Unità / kg in un studio del morsetto euglicemico in pazienti con diabete di tipo 2 (n = 24) e un indice di massa corporea (BMI) tra 20 e 36 kg / m2. Il tempo mediano alla concentrazione massima (Tmax) era di 100 minuti (intervallo da 40 a 120 minuti) e la concentrazione di picco mediana (Cmax) era di 84 microUnità / mL (intervallo da 53 a 165 microUnità / mL) per insulina glulisina rispetto a una Tmax mediana di 240 minuti (intervallo da 80 a 360 minuti) e una Cmax mediana di 41 microUnità / mL (intervallo da 33 a 61 microUnità / mL) per l'insulina umana regolare. (Figura 3.)
Figura 3. Profili farmacocinetici di insulina glulisina e insulina umana regolare in pazienti con diabete di tipo 2 dopo una dose sottocutanea di 0,2 unità / kg.
Quando Apidra è stato iniettato per via sottocutanea in diverse aree del corpo, i profili di concentrazione nel tempo erano simili. La biodisponibilità assoluta dell'insulina glulisina dopo somministrazione sottocutanea è di circa il 70%, indipendentemente dall'area di iniezione (addome 73%, deltoide 71%, coscia 68%).
In uno studio clinico su volontari sani (n = 32) la biodisponibilità totale dell'insulina glulisina era simile dopo sottocutanea iniezione di insulina glulisina e insulina NPH (premiscelata nella siringa) e successiva sottocutanea simultanea separata iniettabili. Si è verificata un'attenuazione del 27% della concentrazione massima (Cmax) di Apidra dopo la premiscelazione; tuttavia, il tempo alla massima concentrazione (Tmax) non è stato influenzato. Non sono disponibili dati sulla miscelazione di Apidra con preparazioni di insulina diverse dall'insulina NPH. [Vedere Studi clinici].
Distribuzione ed eliminazione
La distribuzione e l'eliminazione dell'insulina glulisina e dell'insulina umana regolare dopo endovenosa la somministrazione è simile con volumi di distribuzione di 13 e 21 L e emivite di 13 e 17 minuti, rispettivamente. Dopo somministrazione sottocutanea, l'insulina glulisina viene eliminata più rapidamente dell'insulina umana normale con un'emivita apparente di 42 minuti rispetto a 86 minuti.
Farmacologia clinica in popolazioni specifiche
Pazienti pediatrici
Le proprietà farmacocinetiche e farmacodinamiche di Apidra e dell'insulina umana regolare sono state valutate in a studio condotto su bambini da 7 a 11 anni (n = 10) e adolescenti da 12 a 16 anni (n = 10) con tipo 1 diabete. Le differenze relative di farmacocinetica e farmacodinamica tra Apidra e insulina umana regolare in questi pazienti con diabete di tipo 1 erano simili a quelli di soggetti adulti sani e adulti di tipo 1 diabete.
Gara
Uno studio su 24 soggetti caucasici e giapponesi sani ha confrontato la farmacocinetica e la farmacodinamica dopo l'iniezione sottocutanea di insulina glulisina, insulina lispro e insulina umana regolare. Con l'iniezione sottocutanea di insulina glulisina, i soggetti giapponesi hanno avuto una maggiore esposizione iniziale (33%) per il rapporto tra AUC (0-1h) e AUC (0-clamp end) rispetto ai caucasici (21%) sebbene le esposizioni totali fossero simile. Ci sono stati risultati simili con l'insulina lispro e l'insulina umana regolare.
Obesità
L'insulina glulisina e l'insulina umana regolare sono state somministrate per via sottocutanea alla dose di 0,3 Unità / kg in a studio del morsetto euglicemico in soggetti obesi non diabetici (n = 18) con un indice di massa corporea (BMI) tra 30 e 40 kg / m2. Il tempo mediano alla massima concentrazione (Tmax) era di 85 minuti (intervallo da 49 a 150 minuti) e la concentrazione di picco mediana (Cmax) era di 192 microUnità / mL (intervallo da 98 a 380 microUnità / mL) per insulina glulisina rispetto a una Tmax mediana di 150 minuti (intervallo da 90 a 240 minuti) e una Cmax mediana di 86 microUnità / mL (intervallo da 43 a 175 microUnità / mL) per l'uomo normale insulina.
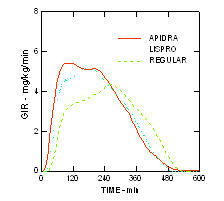
L'inizio più rapido dell'azione e la durata più breve dell'attività di Apidra e insulina lispro rispetto all'insulina umana regolare sono stati mantenuti in una popolazione obesa non diabetica (n = 18). (Figura 4.)
Figura 4. Tassi di infusione di glucosio (GIR) in uno studio di clamp euglicemico dopo iniezione sottocutanea di 0,3 Unità / kg di Apidra, insulina lispro o insulina umana regolare in una popolazione obesa.
Insufficienza renale
Gli studi con insulina umana hanno mostrato un aumento dei livelli circolanti di insulina in pazienti con insufficienza renale. In uno studio condotto su 24 soggetti non diabetici con funzione renale normale (ClCr> 80 mL / min), insufficienza renale moderata (30-50 mL / min) e insufficienza renale grave (Avvertenze e precauzioni].
Insufficienza epatica
L'effetto della compromissione epatica sulla farmacocinetica e farmacodinamica di Apidra non è stato studiato. Alcuni studi con insulina umana hanno mostrato un aumento dei livelli circolanti di insulina in pazienti con insufficienza epatica. [Vedere Avvertenze e precauzioni].
Genere
L'effetto del genere sulla farmacocinetica e farmacodinamica di Apidra non è stato studiato.
Gravidanza
L'effetto della gravidanza sulla farmacocinetica e farmacodinamica di Apidra non è stato studiato.
fumo
L'effetto del fumo sulla farmacocinetica e farmacodinamica di Apidra non è stato studiato.
superiore
Tossicologia non clinica
Cancerogenesi, mutagenesi, compromissione della fertilità
Non sono stati condotti studi standard di carcinogenicità a 2 anni su animali. Nei ratti Sprague Dawley è stato condotto uno studio di tossicità a dose ripetuta di 12 mesi con insulina glulisina a dosi sottocutanee di 2,5, 5, 20 o 50 Unità / kg due volte al giorno (dose risultante in un'esposizione 1, 2, 8 e 20 volte la dose umana media, in base alla superficie corporea confronto).
Si è verificata un'incidenza più elevata non dose-dipendente di tumori della ghiandola mammaria nei ratti femmine a cui è stata somministrata insulina glulisina rispetto ai controlli non trattati. L'incidenza di tumori mammari per l'insulina glulisina e l'insulina umana regolare era simile. La rilevanza di questi risultati per l'uomo non è nota. L'insulina glulisina non è risultata mutagena nei seguenti test: test di Ames, cromosoma di mammifero in vitro test di aberrazione nelle cellule di criceto cinese V79 e test in vivo del micronucleo di eritrociti di mammifero in ratti.
Negli studi di fertilità su ratti maschi e femmine a dosi sottocutanee fino a 10 Unità / kg una volta al giorno (dose che determina un'esposizione 2 volte la media nell'uomo dose, in base al confronto della superficie corporea), nessun chiaro effetto avverso sulla fertilità maschile e femminile o prestazioni riproduttive generali degli animali erano osservato.
superiore
Studi clinici
La sicurezza e l'efficacia di Apidra sono state studiate in pazienti adulti con diabete di tipo 1 e tipo 2 (n = 1833) e in bambini e adolescenti (da 4 a 17 anni) con diabete di tipo 1 (n = 572). Il parametro di efficacia principale in questi studi era il controllo glicemico, valutato usando emoglobina glicata (GHb riportato come equivalente HbA1c).
Diabete di tipo 1-adulti
Uno studio di 26 settimane, randomizzato, in aperto, con controllo attivo, di non inferiorità è stato condotto in pazienti con diabete di tipo 1 per valutare sicurezza ed efficacia di Apidra (n = 339) rispetto all'insulina lispro (n = 333) quando somministrato per via sottocutanea entro 15 minuti prima di un pasto. L'insulina glargine è stata somministrata una volta al giorno la sera come insulina basale. C'è stato un periodo di rodaggio di 4 settimane con insulina lispro e insulina glargine prima della randomizzazione. La maggior parte dei pazienti era di razza caucasica (97%). Il cinquantotto percento dei pazienti erano uomini. L'età media era di 39 anni (da 18 a 74 anni). Il controllo glicemico, il numero di iniezioni giornaliere di insulina ad azione breve e le dosi giornaliere totali di Apidra e insulina lispro erano simili nei due gruppi di trattamento (Tabella 6).
Tabella 6: diabete mellito di tipo 1 - adulto
| Durata del trattamento Trattamento in combinazione con: |
26 settimane Insulina glargine |
|
|---|---|---|
| Apidra | Insulina Lispro | |
| ||
| Emoglobina glicata (GHb)* (%) | ||
| Numero di pazienti | 331 | 322 |
| Media di base | 7.6 | 7.6 |
| Variazione media corretta rispetto al basale | -0.1 | -0.1 |
| Differenza terapeutica: Apidra - Insulina Lispro | 0.0 | |
| IC al 95% per differenza di trattamento | (-0.1; 0.1) | |
| Dose di insulina basale (unità / giorno) | ||
| Media di base | 24 | 24 |
| Variazione media corretta rispetto al basale | 0 | 2 |
| Dose di insulina ad azione breve (Unità / giorno) | ||
| Media di base | 30 | 31 |
| Variazione media corretta rispetto al basale | -1 | -1 |
| Numero medio di iniezioni di insulina ad azione breve al giorno | 3 | 3 |
| Peso corporeo (kg) | ||
| Media di base | 73.9 | 74.1 |
| Variazione media rispetto al basale | 0.6 | 0.3 |
Diabete di tipo 2-adulti
Uno studio di 26 settimane, randomizzato, in aperto, con controllo attivo, di non inferiorità è stato condotto in pazienti trattati con insulina con diabete di tipo 2 per valutare sicurezza ed efficacia di Apidra (n = 435) somministrato entro 15 minuti prima di un pasto rispetto all'insulina umana normale (n = 441) somministrata da 30 a 45 minuti prima di un pasto. L'insulina umana NPH veniva somministrata due volte al giorno come insulina basale. Tutti i pazienti hanno partecipato a un periodo di rodaggio di 4 settimane con insulina umana regolare e insulina umana NPH. L'85% dei pazienti era di razza caucasica e l'11% era di razza nera. L'età media era di 58 anni (intervallo da 26 a 84 anni). L'indice di massa corporea media (BMI) era di 34,6 kg / m2. Alla randomizzazione, il 58% dei pazienti assumeva un agente antidiabetico orale. A questi pazienti è stato chiesto di continuare a usare il loro antidiabetico orale alla stessa dose durante lo studio. La maggior parte dei pazienti (79%) ha miscelato l'insulina a breve durata d'azione con l'insulina umana NPH immediatamente prima dell'iniezione. Le riduzioni dal basale del GHb erano simili tra i 2 gruppi di trattamento (vedere la Tabella 7). Non sono state osservate differenze tra Apidra e i normali gruppi di insulina umana nel numero di iniezioni giornaliere di insulina a breve durata d'azione o dosi di insulina basale o a breve durata d'azione. (Vedi tabella 7.)
Tabella 7: diabete mellito di tipo 2-adulto
| Durata del trattamento | 26 settimane | |
|---|---|---|
| Trattamento in combinazione con: | Insulina umana NPH | |
| Apidra | Insulina umana regolare | |
| ||
| Emoglobina glicata (GHb)* (%) | ||
| Numero di pazienti | 404 | 403 |
| Media di base | 7.6 | 7.5 |
| Variazione media corretta rispetto al basale | -0.5 | -0.3 |
| Differenza di trattamento: Apidra - Insulina umana regolare | -0.2 | |
| IC al 95% per differenza di trattamento | (-0.3; -0.1) | |
| Dose di insulina basale (unità / giorno) | ||
| Media di base | 59 | 57 |
| Variazione media corretta rispetto al basale | 6 | 6 |
| Dose di insulina ad azione breve (Unità / giorno) | ||
| Media di base | 32 | 31 |
| Variazione media corretta rispetto al basale | 4 | 5 |
| Numero medio di iniezioni di insulina ad azione breve al giorno | 2 | 2 |
| Peso corporeo (kg) | ||
| Media di base | 100.5 | 99.2 |
| Variazione media rispetto al basale | 1.8 | 2.0 |
Diabete di tipo 1 per adulti: somministrazione pre e post pasto
È stato condotto uno studio di 12 settimane, randomizzato, in aperto, con controllo attivo, di non inferiorità in pazienti con diabete di tipo 1 per valutare la sicurezza e l'efficacia di Apidra somministrate in momenti diversi rispetto a a pasto. Apidra è stato somministrato per via sottocutanea o entro 15 minuti prima di un pasto (n = 286) o immediatamente dopo a pasto (n = 296) e insulina umana regolare (n = 278) sono stati somministrati per via sottocutanea da 30 a 45 minuti prima di un pasto. L'insulina glargine è stata somministrata una volta al giorno prima di coricarsi come insulina basale. C'è stato un periodo di rodaggio di 4 settimane con insulina umana regolare e insulina glargine seguite da randomizzazione. La maggior parte dei pazienti era di razza caucasica (94%). L'età media era di 40 anni (intervallo da 18 a 73 anni). Il controllo glicemico (vedere Tabella 8) era comparabile per i 3 regimi di trattamento. Non sono stati osservati cambiamenti rispetto al basale tra i trattamenti nel numero giornaliero totale di iniezioni di insulina ad azione breve. (Vedi tabella 8.)
Tabella 8: somministrazione pre e post-pasto nel diabete mellito di tipo 1 per adulti
| Durata del trattamento Trattamento in combinazione con: |
12 settimane insulina glargine |
12 settimane insulina glargine |
12 settimane insulina glargine |
|---|---|---|---|
| Apidra pre pasto |
Apidra pasto post |
Insulina umana regolare | |
| |||
| Emoglobina glicata (GHb)* (%) | |||
| Numero di pazienti | 268 | 276 | 257 |
| Media di base | 7.7 | 7.7 | 7.6 |
| Variazione media corretta rispetto al basale†| -0.3 | -0.1 | -0.1 |
| Dose di insulina basale (unità / giorno) | |||
| Media di base | 29 | 29 | 28 |
| Variazione media corretta rispetto al basale | 1 | 0 | 1 |
| Dose di insulina ad azione breve (Unità / giorno) | |||
| Media di base | 29 | 29 | 27 |
| Variazione media corretta rispetto al basale | -1 | -1 | 2 |
| Numero medio di iniezioni di insulina ad azione breve al giorno | 3 | 3 | 3 |
| Peso corporeo (kg) | |||
| Media di base | 79.2 | 80.3 | 78.9 |
| Variazione media rispetto al basale | 0.3 | -0.3 | 0.3 |
Pazienti diabetici di tipo 1 pediatrici
È stato condotto uno studio di 26 settimane, randomizzato, in aperto, con controllo attivo, di non inferiorità in bambini e adolescenti di età superiore ai 4 anni con tipo 1 diabete mellito per valutare la sicurezza e l'efficacia di Apidra (n = 277) rispetto all'insulina lispro (n = 295) quando somministrato per via sottocutanea entro 15 minuti prima un pasto. I pazienti hanno anche ricevuto insulina glargine (somministrata una volta al giorno la sera) o insulina NPH (somministrata una volta al mattino e una volta alla sera). C'è stato un periodo di rodaggio di 4 settimane con insulina lispro e insulina glargine o NPH prima della randomizzazione. La maggior parte dei pazienti era di razza caucasica (91%). Il 50% dei pazienti era di sesso maschile. L'età media era di 12,5 anni (intervallo da 4 a 17 anni). Il BMI medio era di 20,6 kg / m2. Il controllo glicemico (vedere Tabella 9) era comparabile per i due regimi di trattamento.
Tabella 9: risultati di uno studio di 26 settimane su pazienti pediatrici con diabete mellito di tipo 1
| Apidra | lispro | |
|---|---|---|
| Numero di pazienti | 271 | 291 |
| Insulina basale | NPH o insulina glargine | NPH o insulina glargine |
| ||
| Emoglobina glicata (GHb)* (%) | ||
| Media di base | 8.2 | 8.2 |
| Variazione media corretta rispetto al basale | 0.1 | 0.2 |
| Differenza di trattamento: media (intervallo di confidenza al 95%) | -0.1 (-0.2, 0.1) | |
| Dose di insulina basale (unità / kg / giorno) | ||
| Media di base | 0.5 | 0.5 |
| Variazione media rispetto al basale | 0.0 | 0.0 |
| Dose di insulina ad azione breve (Unità / kg / giorno) | ||
| Media di base | 0.5 | 0.5 |
| Variazione media rispetto al basale | 0.0 | 0.0 |
| Numero medio di iniezioni di insulina ad azione breve al giorno | 3 | 3 |
| Peso corporeo medio basale (kg) | 51.5 | 50.8 |
| Variazione di peso medio rispetto al basale (kg) | 2.2 | 2.2 |
Diabete di tipo 1-Adulti: infusione sottocutanea continua di insulina
Uno studio di controllo attivo randomizzato di 12 settimane (Apidra contro insulina aspart) condotto su adulti con diabete di tipo 1 (Apidra n = 29, insulina aspart n = 30) ha valutato l'uso di Apidra in un'insulina sottocutanea continua esterna pompa. Tutti i pazienti erano caucasici. L'età media era di 46 anni (intervallo da 21 a 73 anni). Il GHb medio è aumentato dal basale all'endpoint in entrambi i gruppi di trattamento (dal 6,8% al 7,0% per Apidra; dal 7,1% al 7,2% per l'insulina aspart).
superiore
Come fornito / Conservazione e gestione
Come fornito
| |
| Apidra 100 unità per ml (U-100) è disponibile come: | |
| Flaconcini da 10 ml | NDC 0088-2500-33 |
| Sistema a cartuccia da 3 ml*, confezione da 5 | NDC 0088-2500-52 |
| Penna preriempita SoloStar da 3 mL, confezione da 5 | NDC 0088-2502-05 |
Gli aghi per penna non sono inclusi nella confezione.
Gli aghi per penna BD Ultra-Fine ™1 da utilizzare in combinazione con OptiClik sono venduti separatamente e sono prodotti da Becton Dickinson and Company.
Solostar è compatibile con tutti gli aghi per penna di Becton Dickinson and Company, Ypsomed e Owen Mumford.
Conservazione
Non utilizzare dopo la data di scadenza (vedere cartone e contenitore).
Flaconcino / sistema a cartuccia non aperti / SoloStar
I flaconcini di Apidra non aperti, i sistemi a cartuccia e SoloStar devono essere conservati in frigorifero, a una temperatura compresa tra 2 ° C-8 ° C (36 ° F-46 ° F). Proteggere dalla luce. Apidra non deve essere conservato nel congelatore e non deve essere consentito il congelamento. Scartare se è stato congelato.
Fiale non chiuse / sistemi a cartuccia / SoloStar non conservati in frigorifero devono essere utilizzati entro 28 giorni.
Fiala aperta (in uso):
Le fiale aperte, refrigerate o meno, devono essere utilizzate entro 28 giorni. Se la refrigerazione non è possibile, la fiala aperta in uso può essere mantenuta non refrigerata per un massimo di 28 giorni lontano dal calore e dalla luce diretti, purché la temperatura non sia superiore a 25 ° C (77 ° F).
Sistema di cartucce aperto (in uso):
Il sistema di cartucce aperto (in uso) inserito in OptiClik® NON deve essere refrigerato ma deve essere tenuto a una temperatura inferiore a 25 ° C (77 ° F) lontano da fonti di calore e luce dirette. Il sistema di cartucce aperto (in uso) deve essere eliminato dopo 28 giorni. Non conservare OptiClik®, con o senza sistema a cartuccia, in frigorifero in qualsiasi momento.
Penna preriempita SoloStar aperta (in uso):
Il SoloStar aperto (in uso) NON deve essere refrigerato, ma deve essere tenuto a una temperatura inferiore a 25 ° C (77 ° F) lontano da fonti di calore e luce dirette. Il SoloStar aperto (in uso) tenuto a temperatura ambiente deve essere eliminato dopo 28 giorni.
Set di infusione:
I set per infusione (serbatoi, tubi e cateteri) e gli Apidra nel serbatoio devono essere eliminati dopo 48 ore di utilizzo o dopo l'esposizione a temperature superiori a 37,6 ° F (37,6 ° F).
Uso endovenoso:
Sacche per infusione preparate come indicato sotto DOSAGGIO E SOMMINISTRAZIONE sono stabili a temperatura ambiente per 48 ore.
Preparazione e gestione
Dopo la diluizione per uso endovenoso, la soluzione deve essere ispezionata visivamente per verificare la presenza di particelle e scolorimento prima della somministrazione. Non utilizzare la soluzione se è diventata torbida o contiene particelle; usare solo se è chiaro e incolore. Apidra non è compatibile con la soluzione di destrosio e la soluzione di Ringers e, pertanto, non può essere utilizzato con questi fluidi in soluzione. L'uso di Apidra con altre soluzioni non è stato studiato ed è pertanto sconsigliato.
Sistema a cartuccia: se OptiClik® (Insulin Delivery Device for Apidra) non funziona correttamente, Apidra può essere aspirato dal sistema a cartuccia in una siringa U-100 e iniettato.
Apidra, insulina glusina, informazioni per il paziente (in inglese semplice)
ultimo aggiornamento: 02/2009
Informazioni dettagliate su segni, sintomi, cause, trattamenti del diabete
Le informazioni contenute in questa monografia non intendono coprire tutti i possibili usi, indicazioni, precauzioni, interazioni farmacologiche o effetti avversi. Questa informazione è generalizzata e non è intesa come consulenza medica specifica. Se ha domande sui medicinali che sta assumendo o desidera maggiori informazioni, consultare il medico, il farmacista o l'infermiere.
torna a: Sfoglia tutti i farmaci per il diabete



