Janumet per il trattamento del diabete
Marchio: Janumet
Nome generico: Sitagliptin e Metformin Hydrochloride
Contenuti:
Indicazioni e utilizzo
Dosaggio e amministrazione
Forme di dosaggio e punti di forza
Controindicazioni
Avvertenze e precauzioni
Reazioni avverse
Interazioni farmacologiche
Utilizzare in popolazioni specifiche
Overdose
Descrizione
Farmacologia
Tossicologia non clinica
Studi clinici
Come fornito
Informazioni sulla consulenza al paziente
Janumet, Sitagliptin e Metformin Hydrochloride, Informazioni paziente (in inglese semplice)
ATTENZIONE: ACIDOSI LATTICA
L'acidosi lattica è una complicanza rara ma grave che può verificarsi a causa dell'accumulo di metformina. Il rischio aumenta con condizioni come sepsi, disidratazione, assunzione eccessiva di alcol, insufficienza epatica, insufficienza renale e insufficienza cardiaca congestizia acuta.
L'inizio è spesso sottile, accompagnato solo da sintomi non specifici come malessere, mialgie, difficoltà respiratoria, aumento della sonnolenza e sofferenza addominale aspecifica. Anomalie di laboratorio includono basso pH, aumento del gap anionico e aumento del lattato nel sangue.
Se si sospetta acidosi, Janumet1 deve essere sospeso e il paziente ricoverato immediatamente. [Vedere Avvertenze e precauzioni]
Indicazioni e utilizzo
Janumet è indicato in aggiunta alla dieta e all'esercizio fisico per migliorare il controllo glicemico negli adulti con diabete mellito di tipo 2 quando è appropriato il trattamento con sitagliptin e metformina. [Vedere Studi clinici.]
Limitazioni d'uso importanti
Janumet non deve essere usato in pazienti con diabete di tipo 1 o per il trattamento della chetoacidosi diabetica, poiché non sarebbe efficace in questi contesti.
Janumet non è stato studiato in associazione con insulina.
superiore
Dosaggio e amministrazione
Dosaggio raccomandato
Il dosaggio della terapia antiiperglicemica con Janumet deve essere personalizzato sulla base dell'attuale regime del paziente, efficacia e tollerabilità pur non superando la dose giornaliera massima raccomandata di 100 mg di sitagliptin e 2000 mg metformina. La terapia di combinazione iniziale o il mantenimento della terapia di combinazione devono essere personalizzati e lasciati alla discrezione del fornitore di assistenza sanitaria.
Janumet deve essere generalmente somministrato due volte al giorno con i pasti, con graduale aumento della dose, per ridurre gli effetti collaterali gastrointestinali (GI) dovuti alla metformina.
La dose iniziale di Janumet deve essere basata sull'attuale regime del paziente. Janumet deve essere somministrato due volte al giorno ai pasti. Sono disponibili le seguenti dosi:
Sitagliptin 50 mg / metformina cloridrato 500 mg
Sitagliptin 50 mg / metformina cloridrato 1000 mg.
Pazienti inadeguatamente controllati con dieta ed esercizio fisico da soli
Se la terapia con una compressa di associazione contenente sitagliptin e metformina è considerata appropriata per un paziente con diabete mellito di tipo 2 inadeguatamente controllato con la dieta e l'esercizio fisico da solo, la dose iniziale raccomandata è 50 mg di sitagliptin / 500 mg di metformina cloridrato due volte quotidiano. I pazienti con controllo glicemico inadeguato su questa dose possono essere titolati fino a 50 mg di sitagliptin / 1000 mg di metformina cloridrato due volte al giorno.
Pazienti non adeguatamente controllati con la monoterapia con metformina
Se la terapia con una compressa di associazione contenente sitagliptin e metformina è considerata appropriata per un paziente non adeguatamente controllato con la sola metformina, il la dose iniziale raccomandata di Janumet deve fornire sitagliptin alla dose di 50 mg due volte al giorno (dose totale giornaliera di 100 mg) e la dose di metformina già prese. Per i pazienti che assumono metformina 850 mg due volte al giorno, la dose iniziale raccomandata di Janumet è 50 mg di sitagliptin / 1000 mg di metformina cloridrato due volte al giorno.
Pazienti inadeguatamente controllati con sitagliptin in monoterapia
Se la terapia con una compressa di associazione contenente sitagliptin e metformina è considerata inadeguata per un paziente controllato con sitagliptin da solo, la dose iniziale raccomandata di Janumet è 50 mg di sitagliptin / 500 mg di metformina cloridrato due volte quotidiano. I pazienti con controllo inadeguato su questa dose possono essere titolati fino a 50 mg di sitagliptin / 1000 mg di metformina cloridrato due volte al giorno. I pazienti che assumono sitagliptin in monoterapia aggiustata per la dose per insufficienza renale non devono passare a Janumet [vedere Controindicazioni].
Pazienti che passano dalla co-somministrazione di sitagliptin e metformina
Per i pazienti che passano da sitagliptin in concomitanza con metformina, Janumet può essere iniziato alla dose di sitagliptin e metformina già in uso.
Pazienti non adeguatamente controllati con terapia a doppia combinazione con due dei seguenti agenti antiiperglicemici: sitagliptin, metformina o una sulfonilurea
Se la terapia con una compressa di associazione contenente sitagliptin e metformina è considerata appropriata in questo impostazione, la dose iniziale abituale di Janumet deve fornire sitagliptin alla dose di 50 mg due volte al giorno (100 mg in totale dose giornaliera). Nel determinare la dose iniziale del componente metformina, devono essere considerati il livello di controllo glicemico del paziente e la dose attuale (se presente) di metformina. Deve essere presa in considerazione un'escalation graduale della dose per ridurre gli effetti collaterali gastrointestinali (GI) associati alla metformina. I pazienti che stanno attualmente assumendo o iniziano una sulfonilurea possono richiedere dosi più basse di sulfonilurea per ridurre il rischio di ipoglicemia [vedere Avvertenze e precauzioni].
Non sono stati condotti studi specifici per esaminare la sicurezza e l'efficacia di Janumet in pazienti precedentemente trattati con altri agenti antiiperglicemici orali e passati a Janumet. Qualsiasi cambiamento nella terapia del diabete di tipo 2 deve essere effettuato con cura e con un adeguato monitoraggio in quanto possono verificarsi cambiamenti nel controllo glicemico.
superiore
Forme di dosaggio e punti di forza
- Le compresse da 50 mg / 500 mg sono compresse di colore rosa chiaro, a forma di capsula, rivestite con film con "575" impresso su un lato.
- Le compresse da 50 mg / 1000 mg sono compresse rivestite con film a forma di capsula rosse con impresso "577" su un lato.
superiore
Controindicazioni
Janumet (sitagliptin / metformin HCl) è controindicato in pazienti con:
- Malattia renale o disfunzione renale, ad esempio, come suggerito dai livelli sierici di creatinina - 1,5 mg / dL [maschi], - 1,4 mg / dL [femmine] o anormali clearance della creatinina che può anche derivare da condizioni quali collasso cardiovascolare (shock), infarto miocardico acuto e setticemia [vedere Avvertenze e precauzioni].
- Acidosi metabolica acuta o cronica, compresa la chetoacidosi diabetica, con o senza coma.
- Storia di una grave reazione di ipersensibilità a Janumet o sitagliptin (uno dei componenti di Janumet), come anafilassi o angioedema. [Vedere Avvertenze e precauzioni e Reazioni avverse.]
Janumet deve essere temporaneamente sospeso nei pazienti sottoposti a studi radiologici che coinvolgono intravascolare somministrazione di materiali di contrasto iodati, poiché l'uso di tali prodotti può provocare alterazioni acute del rene funzione [vedi Avvertenze e precauzioni].
superiore
Avvertenze e precauzioni
Acidosi lattica
Metformina cloridrato
L'acidosi lattica è una rara, ma grave, complicazione metabolica che può verificarsi a causa dell'accumulo di metformina durante il trattamento con Janumet; quando si verifica, è fatale in circa il 50% dei casi. L'acidosi lattica può anche verificarsi in associazione a una serie di condizioni patofisiologiche, incluso il diabete mellito, e ogni volta che vi è una significativa ipoperfusione dei tessuti e ipossiemia. L'acidosi lattica è caratterizzata da elevati livelli di lattato nel sangue (> 5 mmol / L), diminuzione del pH nel sangue, disturbi elettrolitici con un aumento del gap anionico e un rapporto lattato / piruvato aumentato. Quando la metformina è implicata come causa dell'acidosi lattica, si trovano generalmente livelli plasmatici di metformina> 5 µg / mL.
L'incidenza riportata di acidosi lattica nei pazienti trattati con metformina cloridrato è molto bassa (circa 0,03 casi / 1000 anni-paziente, con circa 0,015 casi fatali / 1000 pazienti-anno). In oltre 20.000 pazienti-anni di esposizione alla metformina negli studi clinici, non sono stati segnalati casi di acidosi lattica. Casi segnalati si sono verificati principalmente in pazienti diabetici con insufficienza renale significativa, inclusi entrambi a livello renale intrinseco malattia e ipoperfusione renale, spesso nel contesto di molteplici problemi medico / chirurgici concomitanti e concomitanti multipli farmaci. Pazienti con insufficienza cardiaca congestizia che richiedono una gestione farmacologica, in particolare quelli con instabilità o insufficienza cardiaca congestizia acuta che sono a rischio di ipoperfusione e ipossiemia, sono ad aumentato rischio di lattazione acidosi. Il rischio di acidosi lattica aumenta con il grado di disfunzione renale e l'età del paziente. Pertanto, il rischio di acidosi lattica può essere significativamente ridotto monitorando regolarmente la funzionalità renale nei pazienti che assumono metformina e utilizzando la dose minima efficace di metformina. In particolare, il trattamento degli anziani deve essere accompagnato da un attento monitoraggio della funzionalità renale. Il trattamento con metformina non deve essere iniziato in pazienti di età pari o superiore a 80 anni, a meno che la misurazione della clearance della creatinina dimostra che la funzionalità renale non è ridotta, poiché questi pazienti sono più sensibili allo sviluppo di acidosi lattica. Inoltre, la metformina deve essere prontamente trattenuta in presenza di qualsiasi condizione associata a ipossiemia, disidratazione o sepsi. Poiché una compromissione della funzionalità epatica può limitare in modo significativo la capacità di eliminare il lattato, la metformina deve essere generalmente evitata in pazienti con evidenza clinica o di laboratorio di malattia epatica. I pazienti devono essere avvertiti contro l'assunzione eccessiva di alcol, acuta o cronica, durante l'assunzione di metformina, poiché l'alcol potenzia gli effetti della metformina cloridrato sul metabolismo del lattato. Inoltre, la metformina deve essere temporaneamente sospesa prima di qualsiasi studio di radiocontrasto intravascolare e per qualsiasi procedura chirurgica [vedere Avvertenze e precauzioni].
L'inizio dell'acidosi lattica è spesso sottile e accompagnato solo da sintomi non specifici come malessere, mialgie, difficoltà respiratoria, aumento della sonnolenza e sofferenza addominale aspecifica. Ci possono essere associati ipotermia, ipotensione e bradiaritmie resistenti con acidosi più marcata. Il paziente e il medico del paziente devono essere consapevoli della possibile importanza di tali sintomi e il paziente deve essere istruito a informare immediatamente il medico se si verificano [vedere Avvertenze e precauzioni]. La metformina deve essere ritirata fino a quando la situazione non viene chiarita. Possono essere utili elettroliti sierici, chetoni, glucosio nel sangue e, se indicato, pH del sangue, livelli di lattato e persino livelli di metformina nel sangue. Una volta che un paziente è stabilizzato a qualsiasi livello di dose di metformina, è improbabile che i sintomi gastrointestinali, che sono comuni all'inizio della terapia, siano correlati al farmaco. La comparsa successiva di sintomi gastrointestinali potrebbe essere dovuta all'acidosi lattica o ad altre malattie gravi.
I livelli di lattato venoso a digiuno al di sopra del limite superiore del normale ma inferiore a 5 mmol / L nei pazienti che assumono metformina non indicano necessariamente una lattazione imminente acidosi e può essere spiegabile con altri meccanismi, come diabete o obesità scarsamente controllati, attività fisica vigorosa o problemi tecnici nella gestione dei campioni [vedere Avvertenze e precauzioni].
L'acidosi lattica deve essere sospettata in tutti i pazienti diabetici con acidosi metabolica priva di evidenza di chetoacidosi (chetonuria e chetonemia).
L'acidosi lattica è un'emergenza medica che deve essere curata in ambito ospedaliero. In un paziente con acidosi lattica che sta assumendo metformina, il farmaco deve essere immediatamente sospeso e devono essere istituite tempestivamente misure di supporto generali. Perché la metformina cloridrato è dializzabile (con una clearance fino a 170 ml / min in buone condizioni emodinamiche condizioni), si raccomanda una pronta emodialisi per correggere l'acidosi e rimuovere l'accumulo metformina. Tale gestione spesso porta a una pronta inversione dei sintomi e al recupero [vedi Controindicazioni; Avvertenze e precauzioni].
Funzione epatica compromessa
Poiché la compromissione della funzionalità epatica è stata associata ad alcuni casi di acidosi lattica, Janumet deve essere generalmente evitato in pazienti con evidenza clinica o di laboratorio di malattia epatica.
Valutazione della funzione renale
La metformina e il sitagliptin sono noti per essere sostanzialmente escreti dal rene. Il rischio di accumulo di metformina e acidosi lattica aumenta con il grado di compromissione della funzionalità renale. Pertanto, i pazienti con livelli sierici di creatinina al di sopra del limite superiore della norma per la loro età non devono ricevere Janumet. Negli anziani, Janumet deve essere attentamente titolato per stabilire la dose minima per un adeguato effetto glicemico, poiché l'invecchiamento può essere associato a una ridotta funzionalità renale. [Vedere Avvertenze e precauzioni e Utilizzare in popolazioni specifiche.]
Prima di iniziare la terapia con Janumet e almeno successivamente ogni anno, la funzionalità renale deve essere valutata e verificata normalmente. Nei pazienti in cui è previsto lo sviluppo di disfunzione renale, in particolare nei pazienti anziani, renale la funzione deve essere valutata più frequentemente e Janumet deve essere sospeso se è presente evidenza di insufficienza renale presente.
Vitamina B12 livelli
In studi clinici controllati sulla metformina della durata di 29 settimane, una riduzione ai livelli non normali della vitamina B sierica precedentemente normale12 livelli, senza manifestazioni cliniche, sono stati osservati in circa il 7% dei pazienti. Tale diminuzione, probabilmente a causa di interferenze con B12 assorbimento dalla B12complesso di fattori intrinseci, tuttavia, è molto raramente associato all'anemia e sembra essere rapidamente reversibile con l'interruzione della metformina o della vitamina B12 supplementazione. La misurazione dei parametri ematologici su base annuale è consigliata nei pazienti trattati con Janumet ed eventuali anomalie apparenti devono essere adeguatamente studiate e gestite. [Vedere Reazioni avverse.]
Alcuni individui (quelli con inadeguata vitamina B12 o l'assunzione o l'assorbimento di calcio) sembrano predisposti allo sviluppo di vitamina B non normale12 livelli. In questi pazienti, siero di routine Vitamina B12 possono essere utili misurazioni a intervalli di due o tre anni.
Assunzione di alcol
È noto che l'alcol potenzia l'effetto della metformina sul metabolismo del lattato. I pazienti, pertanto, devono essere avvertiti dall'assunzione eccessiva di alcol, acuta o cronica, durante il trattamento con Janumet.
Procedure chirurgiche
L'uso di Janumet deve essere temporaneamente sospeso per qualsiasi procedura chirurgica (ad eccezione delle procedure minori non associate all'assunzione limitata di cibo e liquidi) e non deve essere riavviato fino a quando l'assunzione orale del paziente non è stata ripresa e la funzione renale non è stata valutata come normale.
Modifica dello stato clinico dei pazienti con diabete di tipo 2 precedentemente controllato
Un paziente con diabete di tipo 2 precedentemente ben controllato su Janumet che sviluppa anomalie di laboratorio o cliniche la malattia (specialmente quella vaga e mal definita) deve essere valutata prontamente per prove di chetoacidosi o lattica acidosi. La valutazione dovrebbe includere elettroliti sierici e chetoni, glicemia e, se indicato, livelli ematici di pH, lattato, piruvato e metformina. In caso di acidosi di entrambe le forme, Janumet deve essere immediatamente interrotto e devono essere avviate altre misure correttive appropriate.
Utilizzare con farmaci noti per causare ipoglicemia
sitagliptin
Come è tipico con altri agenti antiiperglicemici usati in associazione con una sulfonilurea, quando sitagliptin è stato usato in associazione con metformina e sulfonilurea, un farmaco noto per causare ipoglicemia, l'incidenza dell'ipoglicemia è stata aumentata rispetto a quella del placebo in associazione con metformina e sulfonilurea [vedi Reazioni avverse]. Pertanto, i pazienti che ricevono anche un secretagogo dell'insulina (ad es. Sulfonilurea, meglitinide) possono richiedere una dose più bassa del secretagogo dell'insulina per ridurre il rischio di ipoglicemia [vedere Dosaggio e amministrazione].
Metformina cloridrato
L'ipoglicemia non si verifica nei pazienti che assumono metformina da sola nelle normali circostanze d'uso, ma può verificarsi quando l'assunzione calorica è carente, quando un intenso esercizio fisico non è compensato dalla supplementazione calorica o durante l'uso concomitante con altri agenti ipoglicemizzanti (come sulfoniluree e insulina) o etanolo. I pazienti anziani, debilitati o malnutriti e quelli con insufficienza surrenalica o ipofisaria o intossicazione da alcol sono particolarmente sensibili agli effetti ipoglicemizzanti. L'ipoglicemia può essere difficile da riconoscere negli anziani e nelle persone che assumono farmaci bloccanti β-adrenergici.
Farmaci concomitanti che influenzano la funzionalità renale o la disposizione della metformina
Farmaci concomitanti che possono influenzare la funzionalità renale o provocare significativi cambiamenti emodinamici o possono interferire con la disposizione della metformina, come i farmaci cationici che vengono eliminati dalla secrezione tubulare renale [vedere Interazioni farmacologiche], deve essere usato con cautela.
Studi radiologici con materiali di contrasto iodinated intravascolare
Studi di contrasto intravascolare con materiali iodati (ad esempio, urogramma endovenoso, colangiografia endovenosa, angiografia e tomografia computerizzata (TC) con materiali di contrasto intravascolare) può portare a un'alterazione acuta della funzionalità renale e sono stati associati ad acidosi lattica in pazienti in trattamento con metformina [vedi Controindicazioni]. Pertanto, nei pazienti in cui è previsto tale studio, Janumet deve essere temporaneamente sospeso al momento o prima della e trattenuta per 48 ore successive alla procedura e ripristinata solo dopo che la funzione renale è stata rivalutata e trovata a sii normale.
Stati ipossici
Collasso cardiovascolare (shock) da qualsiasi causa, insufficienza cardiaca congestizia acuta, infarto miocardico acuto e altre condizioni caratterizzate da ipossiemia sono state associate all'acidosi lattica e possono anche causare prerenale azotemia. Quando si verificano tali eventi in pazienti in terapia con Janumet, il farmaco deve essere prontamente sospeso.
Perdita di controllo del glucosio nel sangue
Quando un paziente stabilizzato su qualsiasi regime diabetico è esposto a stress come febbre, traumi, infezioni o interventi chirurgici, può verificarsi una temporanea perdita di controllo glicemico. In tali momenti, potrebbe essere necessario trattenere Janumet e somministrare temporaneamente insulina. Janumet può essere ripristinato dopo che l'episodio acuto è stato risolto.
Reazioni di ipersensibilità
Sono stati segnalati casi post-marketing di gravi reazioni di ipersensibilità in pazienti trattati con sitagliptin, uno dei componenti di Janumet. Queste reazioni includono anafilassi, angioedema e condizioni della pelle esfoliativa, inclusa la sindrome di Stevens-Johnson. Poiché queste reazioni sono segnalate volontariamente da una popolazione di dimensioni incerte, lo è generalmente non è possibile stimare in modo affidabile la loro frequenza o stabilire una relazione causale con l'esposizione al farmaco. L'inizio di queste reazioni si è verificato entro i primi 3 mesi dopo l'inizio del trattamento con sitagliptin, con alcune segnalazioni che si verificano dopo la prima dose. Se si sospetta una reazione di ipersensibilità, interrompere Janumet, valutare altre potenziali cause dell'evento e istituire un trattamento alternativo per il diabete. [Vedere Reazioni avverse.]
Esiti macrovascolari
Non sono stati condotti studi clinici per stabilire prove conclusive della riduzione del rischio macrovascolare con Janumet o altri farmaci antidiabetici.
superiore
Reazioni avverse
Esperienza di prove cliniche
Poiché gli studi clinici sono condotti in condizioni ampiamente variabili, i tassi di reazioni avverse osservati negli studi clinici di a il farmaco non può essere direttamente confrontato con i tassi negli studi clinici di un altro farmaco e potrebbe non riflettere i tassi osservati in pratica.
Co-somministrazione di sitagliptin e metformina in pazienti con diabete di tipo 2 non adeguatamente controllati con dieta ed esercizio fisico
La tabella 1 riassume le reazioni avverse più comuni (5 ¥ 5% dei pazienti) riportate (indipendentemente dalla valutazione della causalità dello sperimentatore) in una settimana studio fattoriale controllato con placebo in cui sitagliptin e metformina sono stati somministrati in associazione a pazienti con diabete di tipo 2 non adeguatamente controllati con la dieta ed esercizio fisico.
Tabella 1: Sitagliptin e metformina somministrati in associazione a pazienti con diabete di tipo 2 non adeguatamente controllati dalla dieta e dall'esercizio fisico: reazioni avverse Riferito (indipendentemente dalla valutazione dello sperimentatore della causalità) in circa il 5% dei pazienti sottoposti a terapia di combinazione (e maggiore rispetto ai pazienti in trattamento Placebo)*
| Numero di pazienti (%) | ||||
Placebo |
sitagliptin 100 mg QD |
Metformina 500 mg / Metformina 1000 mg bid†|
sitagliptin 50 mg di offerta + Metformina 500 mg / Metformina 1000 mg bid†|
|
| N = 176 | N = 179 | N = 364†| N = 372†| |
| ||||
| Diarrea | 7 (4.0) | 5 (2.8) | 28 (7.7) | 28 (7.5) |
| Infezione del tratto respiratorio superiore | 9 (5.1) | 8 (4.5) | 19 (5.2) | 23 (6.2) |
| Mal di testa | 5 (2.8) | 2 (1.1) | 14 (3.8) | 22 (5.9) |
Terapia aggiuntiva con Sitagliptin in pazienti con diabete di tipo 2 non adeguatamente controllati con metformina da sola
In uno studio di sitagliptin 100 mg controllato con placebo della durata di 24 settimane somministrato una volta al giorno aggiunto a un regime di metformina due volte al giorno, non sono stati osservati reazioni avverse riportate indipendentemente dalla valutazione da parte dello sperimentatore della causalità nel 5% dei pazienti e più comunemente che nei pazienti trattati placebo. L'interruzione della terapia a causa di reazioni avverse cliniche è stata simile al gruppo trattato con placebo (sitagliptin e metformina, 1,9%; placebo e metformina, 2,5%).
L'ipoglicemia
Le reazioni avverse di ipoglicemia sono state basate su tutte le segnalazioni di ipoglicemia; non era richiesta una misurazione simultanea del glucosio. L'incidenza complessiva di reazioni avverse predefinite di ipoglicemia nei pazienti con diabete di tipo 2 non adeguatamente controllati con la dieta e l'esercizio è stata dello 0,6% pazienti trattati con placebo, 0,6% nei pazienti trattati con sitagliptin da solo, 0,8% nei pazienti trattati con sola metformina e 1,6% nei pazienti trattati con sitagliptin in associazione con metformina. Nei pazienti con diabete di tipo 2 non adeguatamente controllati con la sola metformina, l'incidenza complessiva di eventi avversi le reazioni di ipoglicemia sono state dell'1,3% nei pazienti trattati con sitagliptin aggiuntivo e del 2,1% nei pazienti trattati con add-on placebo.
Reazioni avverse gastrointestinali
L'incidenza di esperienze avverse gastrointestinali preselezionate nei pazienti trattati con sitagliptin e metformina sono state simili a quelle riportate per i pazienti trattati con la sola metformina. Vedi tabella 2
Tabella 2: Reazioni avverse gastrointestinali preselezionate (indipendentemente dalla valutazione dello sperimentatore sulla causalità) riportate nei pazienti con diabete di tipo 2 che ricevono Sitagliptin e metformina.
| Numero di pazienti (%) | ||||||
| Studio di Sitagliptin e Metformin in pazienti non adeguatamente controllati su dieta ed esercizio fisico |
Studio del componente aggiuntivo Sitagliptin in pazienti non adeguatamente controllati con metformina da sola | |||||
Placebo |
sitagliptin 100 mg QD |
Metformina 500 mg / Metformina 1000 mg bid* |
sitagliptin 50 mg di offerta + Metformina 500 mg / Metformina 1000 mg bid* |
Placebo e metformina â ‰ ¥ 1500 mg al giorno |
Sitagliptin 100 mg QD e metformina â ‰ ¥ 1500 mg al giorno |
|
| N = 176 | N = 179 | N = 364 | N = 372 | N = 237 | N = 464 | |
| ||||||
| Diarrea | 7 (4.0) | 5 (2.8) | 28 (7.7) | 28 (7.5) | 6 (2.5) | 11 (2.4) |
| Nausea | 2 (1.1) | 2 (1.1) | 20 (5.5) | 18 (4.8) | 2 (0.8) | 6 (1.3) |
| vomito | 1 (0.6) | 0 (0.0) | 2 (0.5) | 8 (2.2) | 2 (0.8) | 5 (1.1) |
| Dolore addominale†| 4 (2.3) | 6 (3.4) | 14 (3.8) | 11 (3.0) | 9 (3.8) | 10 (2.2) |
Sitagliptin in combinazione con metformina e glimepiride
In uno studio di placebo di 24 settimane di sitagliptin 100 mg come terapia aggiuntiva in pazienti con diabete di tipo 2 non adeguatamente controllato su metformina e glimepiride (sitagliptin, N = 116; placebo, N = 113), le reazioni avverse riportate indipendentemente dalla valutazione dello causalità dello sperimentatore nel 5% dei pazienti trattati con sitagliptin e più comunemente che nei pazienti trattati con placebo sono stati: ipoglicemia (sitagliptin, 16,4%; placebo, 0,9%) e mal di testa (6,9%, 2,7%).
Non sono stati osservati cambiamenti clinicamente significativi nei segni vitali o nell'ECG (incluso nell'intervallo QTc) con l'associazione di sitagliptin e metformina.
L'esperienza avversa più comune in sitagliptin in monoterapia è stata riferita indipendentemente dallo sperimentatore è stata la valutazione della causalità nel 5% dei pazienti e più comunemente che nei pazienti trattati con placebo nasofaringite.
Le reazioni avverse stabilite più comuni (> 5%) dovute all'inizio della terapia con metformina sono diarrea, nausea / vomito, flatulenza, fastidio addominale, indigestione, astenia e mal di testa.
Test di laboratorio
sitagliptin
L'incidenza delle reazioni avverse di laboratorio è stata simile nei pazienti trattati con sitagliptin e metformina (7,6%) rispetto ai pazienti trattati con placebo e metformina (8,7%). Nella maggior parte ma non in tutti gli studi, un piccolo aumento della conta dei globuli bianchi (circa 200 cellule / microL di differenza tra WBC e placebo; WBC medio basale è stato osservato circa 6600 cellule / microL) a causa di un piccolo aumento dei neutrofili. Questa modifica dei parametri di laboratorio non è considerata clinicamente rilevante.
Metformina cloridrato
In studi clinici controllati sulla metformina della durata di 29 settimane, una riduzione ai livelli non normali della vitamina B sierica precedentemente normale12 livelli, senza manifestazioni cliniche, sono stati osservati in circa il 7% dei pazienti. Tale diminuzione, probabilmente a causa di interferenze con B12 assorbimento dalla B12complesso di fattori intrinseci, tuttavia, è molto raramente associato all'anemia e sembra essere rapidamente reversibile con l'interruzione della metformina o della vitamina B12 supplementazione. [Vedere Avvertenze e precauzioni.]
Esperienza post-marketing
Le seguenti ulteriori reazioni avverse sono state identificate durante l'uso post-approvazione di Janumet o sitagliptin, uno dei componenti di Janumet. Poiché queste reazioni sono segnalate volontariamente da una popolazione di dimensioni incerte, lo è generalmente non è possibile stimare in modo affidabile la loro frequenza o stabilire una relazione causale con l'esposizione al farmaco.
Le reazioni di ipersensibilità comprendono anafilassi, angioedema, eruzione cutanea, orticaria, vasculite cutanea e condizioni esfoliative della pelle inclusa la sindrome di Stevens-Johnson [vedi Avvertenze e precauzioni]; infezione del tratto respiratorio superiore; elevazione degli enzimi epatici; pancreatite.
superiore
Interazioni farmacologiche
Droghe cationiche
Farmaci cationici (ad es. Amiloride, digossina, morfina, procainamide, chinidina, chinina, ranitidina, triamterene, trimetoprim o vancomicina) che sono eliminati dalla secrezione tubulare renale hanno teoricamente il potenziale per l'interazione con metformina competendo per il trasporto tubulare renale comune sistemi. Tale interazione tra metformina e cimetidina orale è stata osservata in volontari sani normali in metformina-cimetidina a dose singola e multipla studi di interazione farmacologica, con un aumento del 60% del picco della metformina nel plasma e delle concentrazioni di sangue intero e un aumento del 40% nel plasma e della metformina del sangue intero AUC. Non è stato osservato alcun cambiamento nell'emivita di eliminazione nello studio con dose singola. La metformina non ha avuto effetti sulla farmacocinetica della cimetidina. Sebbene tali interazioni rimangano teoriche (ad eccezione della cimetidina), un attento monitoraggio del paziente e un aggiustamento della dose di Janumet e / o si raccomanda un farmaco interferente nei pazienti che assumono farmaci cationici che vengono escreti attraverso la secrezione tubulare renale prossimale sistema.
digossina
C'è stato un leggero aumento dell'area sotto la curva (AUC, 11%) e picco di concentrazione del farmaco medio (Cmax, 18%) di digossina con la co-somministrazione di sitagliptin 100 mg per 10 giorni. Questi aumenti non sono considerati probabilmente clinicamente significativi. La digossina, come farmaco cationico, ha il potenziale per competere con la metformina per i comuni sistemi di trasporto tubulare renale, influenzando così le concentrazioni sieriche di digossina, metformina o entrambi. I pazienti che ricevono digossina devono essere monitorati in modo appropriato. Non è raccomandato alcun aggiustamento del dosaggio di digossina o Janumet.
Glyburide
In uno studio di interazione a dose singola in pazienti con diabete di tipo 2, la somministrazione concomitante di metformina e glicburide non ha comportato cambiamenti né nella farmacocinetica della metformina né nella farmacodinamica. Diminuzioni di AUC e C di gliburidemax sono stati osservati, ma erano altamente variabili. La natura monodose di questo studio e la mancanza di correlazione tra i livelli ematici di gliburide e gli effetti farmacodinamici rendono incerto il significato clinico di questa interazione.
furosemide
Uno studio di interazione farmacologica a dose singola, metformina-furosemide in soggetti sani ha dimostrato che i parametri farmacocinetici di entrambi i composti sono stati influenzati dalla co-somministrazione. Furosemide ha aumentato il plasma della metformina e il sangue Cmax del 22% e AUC ematica del 15%, senza alcun cambiamento significativo nella clearance renale della metformina. Quando somministrato con metformina, il C.max e AUC di furosemide erano rispettivamente più piccole del 31% e del 12% rispetto a quando somministrate da sole e l'emivita terminale è stata ridotta del 32%, senza alcun cambiamento significativo nella furosemide renale spazio. Non sono disponibili informazioni sull'interazione di metformina e furosemide in caso di co-somministrazione cronica.
nifedipina
Uno studio di interazione farmacologica a dose singola, metformina-nifedipina in volontari sani normali ha dimostrato che la co-somministrazione di nifedipina ha aumentato la metformina C nel plasmamax e AUC del 20% e del 9%, rispettivamente, e ha aumentato la quantità escreta nelle urine. Tmax e l'emivita non sono state influenzate. La nifedipina sembra migliorare l'assorbimento della metformina. La metformina ha avuto effetti minimi sulla nifedipina.
L'uso della metformina con altri farmaci
Alcuni farmaci tendono a produrre iperglicemia e possono portare alla perdita di controllo glicemico. Questi farmaci includono i tiazidici e altri diuretici, corticosteroidi, fenotiazine, prodotti tiroidei, estrogeni, contraccettivi orali, fenitoina, acido nicotinico, simpaticomimetici, farmaci bloccanti i canali del calcio e isoniazide. Quando tali farmaci vengono somministrati a un paziente che riceve Janumet, il paziente deve essere attentamente osservato per mantenere un adeguato controllo glicemico.
In volontari sani, la farmacocinetica di metformina e propranololo e metformina e ibuprofene non sono state influenzate quando somministrati in concomitanza con studi di interazione a dose singola.
La metformina è legata in modo trascurabile alle proteine plasmatiche ed è quindi meno probabile che interagisca con farmaci altamente legati alle proteine come salicilati, sulfamidici, cloramfenicolo e probenecid, rispetto alle sulfoniluree, che sono ampiamente legate al siero proteine.
superiore
Utilizzare in popolazioni specifiche
Gravidanza
Categoria di gravidanza B:
Janumet
Non esistono studi adeguati e ben controllati su donne in gravidanza con Janumet o suoi singoli componenti; pertanto, la sicurezza di Janumet nelle donne in gravidanza non è nota. Janumet deve essere usato durante la gravidanza solo se chiaramente necessario.
Merck & Co., Inc. mantiene un registro per monitorare gli esiti della gravidanza delle donne esposte a Janumet durante la gravidanza. Gli operatori sanitari sono incoraggiati a segnalare qualsiasi esposizione prenatale a Janumet chiamando il registro delle gravidanze al numero (800) 986-8999.
Non sono stati condotti studi sugli animali con i prodotti combinati di Janumet per valutare gli effetti sulla riproduzione. I seguenti dati si basano sui risultati di studi condotti con sitagliptin o metformina singolarmente.
sitagliptin
Studi sulla riproduzione sono stati condotti su ratti e conigli. Dosi di sitagliptin fino a 125 mg / kg (circa 12 volte l'esposizione umana alla dose umana massima raccomandata) non hanno compromesso la fertilità o danneggiato il feto. Non ci sono, tuttavia, studi adeguati e ben controllati con sitagliptin in donne in gravidanza.
Sitagliptin somministrato a ratti e conigli femmine in gravidanza dal 6 ° al 20 ° giorno di gestazione (organogenesi) non è stato teratogeno a dosi orali fino a 250 mg / kg (ratti) e 125 mg / kg (conigli), o circa 30 e 20 volte l'esposizione umana alla dose massima raccomandata nell'uomo (MRHD) di 100 mg / giorno in base all'AUC confronti. Dosi più elevate hanno aumentato l'incidenza di malformazioni costali nella prole a 1000 mg / kg, o circa 100 volte l'esposizione umana all'MRHD.
Sitagliptin somministrato alle femmine di ratto dal giorno della gestazione 6 al giorno della lattazione 21 ha ridotto il peso corporeo nella prole maschile e femminile a 1000 mg / kg. Nessuna tossicità funzionale o comportamentale è stata osservata nella prole dei ratti.
Il trasferimento placentare di sitagliptin somministrato a ratti gravidi è stato di circa il 45% a 2 ore e l'80% a 24 ore dopo la dose. Il trasferimento placentare di sitagliptin somministrato a conigli gravidi è stato di circa il 66% a 2 ore e il 30% a 24 ore.
Metformina cloridrato
La metformina non era teratogena nei ratti e nei conigli a dosi fino a 600 mg / kg / die. Ciò rappresenta un'esposizione di circa 2 e 6 volte la dose massima giornaliera raccomandata nell'uomo di 2.000 mg sulla base dei confronti della superficie corporea rispettivamente per ratti e conigli. La determinazione delle concentrazioni fetali ha dimostrato una parziale barriera placentare alla metformina.
Madri che allattano
Non sono stati condotti studi su animali in allattamento con i componenti combinati di Janumet. Negli studi condotti con i singoli componenti, sia sitagliptin che metformina sono secreti nel latte dei ratti in allattamento. Non è noto se sitagliptin sia escreto nel latte materno. Poiché molti farmaci vengono escreti nel latte materno, è necessario prestare attenzione quando Janumet viene somministrato a una donna che allatta.
Uso pediatrico
La sicurezza e l'efficacia di Janumet nei pazienti pediatrici di età inferiore a 18 anni non sono state stabilite.
Uso geriatrico
Janumet
Poiché sitagliptin e metformina sono sostanzialmente escreti dal rene e poiché l'invecchiamento può essere associato a ridotta funzionalità renale, Janumet deve essere usato con cautela all'aumentare dell'età. Prestare attenzione nella selezione della dose e basarsi su un attento e regolare monitoraggio della funzionalità renale. [Vedere Avvertenze e precauzioni; Farmacologia clinica.]
sitagliptin
Del numero totale di soggetti (N = 3884) negli studi clinici di fase II e III su sitagliptin, 725 pazienti avevano 65 anni e oltre, mentre 61 pazienti avevano 75 anni e oltre. Non sono state osservate differenze generali in termini di sicurezza o efficacia tra soggetti di età pari o superiore a 65 anni e soggetti più giovani. Mentre questa e altre esperienze cliniche riportate non hanno identificato differenze nelle risposte tra gli anziani e i pazienti più giovani, una maggiore sensibilità di alcuni individui più anziani non può essere escluso.
Metformina cloridrato
Gli studi clinici controllati sulla metformina non hanno incluso un numero sufficiente di pazienti anziani per determinare se rispondono in modo diverso da pazienti più giovani, sebbene altre esperienze cliniche riportate non abbiano identificato differenze nelle risposte tra anziani e giovani pazienti. La metformina deve essere utilizzata solo in pazienti con normale funzionalità renale. La dose iniziale e di mantenimento della metformina deve essere conservativa nei pazienti in età avanzata, a causa del potenziale di riduzione della funzionalità renale in questa popolazione. Qualsiasi aggiustamento della dose deve essere basato su un'attenta valutazione della funzionalità renale. [Vedere Controindicazioni; Avvertenze e precauzioni; e Farmacologia clinica.]
superiore
Overdose
sitagliptin
Durante gli studi clinici controllati su soggetti sani, sono state somministrate dosi singole fino a 800 mg di sitagliptin. In uno studio sono stati osservati aumenti medi massimi del QTc di 8,0 msec alla dose di sitagliptin 800 mg, un effetto medio che non è considerato clinicamente importante [vedere Farmacologia clinica]. Non esiste esperienza con dosi superiori a 800 mg nell'uomo. Negli studi di dose multipla di Fase I, non sono state osservate reazioni avverse cliniche correlate alla dose con sitagliptin con dosi fino a 400 mg al giorno per periodi fino a 28 giorni.
In caso di sovradosaggio, è ragionevole utilizzare le consuete misure di supporto, ad esempio rimuovere il materiale non assorbito dal tratto gastrointestinale tratto, impiegare il monitoraggio clinico (incluso l'ottenimento di un elettrocardiogramma) e istituire una terapia di supporto come indicato dalla clinica del paziente stato.
Sitagliptin è modestamente dializzabile. Negli studi clinici, circa il 13,5% della dose è stata rimossa in una sessione di emodialisi di 3-4 ore. L'emodialisi prolungata può essere presa in considerazione se clinicamente appropriata. Non è noto se sitagliptin sia dializzabile per dialisi peritoneale.
Metformina cloridrato
Si è verificato un sovradosaggio di metformina cloridrato, inclusa l'ingestione di quantità superiori a 50 grammi. Ipoglicemia è stata riportata in circa il 10% dei casi, ma non è stata stabilita alcuna associazione causale con metformina cloridrato. L'acidosi lattica è stata segnalata in circa il 32% dei casi di sovradosaggio da metformina [vedi Avvertenze e precauzioni]. La metformina è dializzabile con una clearance fino a 170 ml / min in buone condizioni emodinamiche. Pertanto, l'emodialisi può essere utile per la rimozione del farmaco accumulato da pazienti in cui si sospetta un sovradosaggio di metformina.
superiore
Descrizione
Le compresse di Janumet (sitagliptin / metformin HCl) contengono due farmaci antiiperglicemici orali utilizzati nella gestione del diabete di tipo 2: sitagliptin e metformina cloridrato.
sitagliptin
Sitagliptin è un inibitore attivo per via orale dell'enzima dipeptidil peptidasi-4 (DPP-4). Sitagliptin è presente nelle compresse di Janumet sotto forma di sitagliptin fosfato monoidrato. Sitagliptin fosfato monoidrato è descritto chimicamente come 7 - [(3R) - 3 - amino - 1 - oxo - 4 - (2,4,5 - trifluorofenil) butile] - 5,6,7,8 - tetraidro - 3 - (trifluorometil) - 1,2,4 - triazolo [4,3 - a] pirazina fosfato (1: 1) monoidrato con una formula empirica di C16H15F6N5OH3PO4-H2O e un peso molecolare di 523,32. La formula strutturale è:

Sitagliptin fosfato monoidrato è una polvere da bianca a biancastra, cristallina, non igroscopica. È solubile in acqua e N, N-dimetil formammide; leggermente solubile in metanolo; leggermente solubile in etanolo, acetone e acetonitrile; e insolubile in isopropanolo e isopropil acetato.
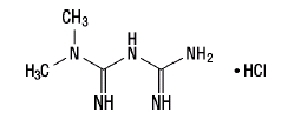
Metformina cloridrato
La metformina cloridrato (N, N-dimetilimidodicarbonimidico diamide cloridrato) non è chimicamente o farmacologicamente correlata ad altre classi di agenti antiiperglicemici orali. La metformina cloridrato è un composto cristallino da bianco a biancastro con una formula molecolare di C4H11N5-HCl e un peso molecolare di 165,63. La metformina cloridrato è liberamente solubile in acqua ed è praticamente insolubile in acetone, etere e cloroformio. Il pKun' di metformina è 12.4. Il pH di una soluzione acquosa all'1% di metformina cloridrato è 6,68. La formula strutturale è come mostrato:
Janumet
Janumet è disponibile per somministrazione orale in compresse contenenti 64,25 mg di sitagliptin fosfato monoidrato e metformina cloridrato equivalente a: 50 mg di sitagliptin come base libera e 500 mg di metformina cloridrato (Janumet 50 mg / 500 mg) o 1000 mg di metformina cloridrato (Janumet 50 mg / 1000 mg). Ogni compressa rivestita con film di Janumet contiene i seguenti ingredienti inattivi: cellulosa microcristallina, polivinilpirrolidone, sodio lauril solfato e sodio stearil fumarato. Inoltre, il rivestimento del film contiene i seguenti ingredienti inattivi: alcool polivinilico, polietilenglicole, talco, biossido di titanio, ossido di ferro rosso e ossido di ferro nero.
superiore
Farmacologia clinica
Meccanismo di azione
Janumet
Janumet combina due agenti antiiperglicemici con meccanismi d'azione complementari per migliorare il controllo glicemico nei pazienti con diabete di tipo 2: sitagliptin, un inibitore della dipeptidil peptidasi-4 (DPP-4) e metformina cloridrato, un membro della biguanide classe.
sitagliptin
Sitagliptin è un inibitore del DPP-4, che si ritiene eserciti le sue azioni nei pazienti con diabete di tipo 2 rallentando l'inattivazione degli ormoni incretinici. Sitagliptin aumenta le concentrazioni degli ormoni attivi intatti, aumentando e prolungando così l'azione di questi ormoni. Ormoni di Incretin, incluso peptide-1 (GLP-1) simile al glucagone e insulinotropico glucosio-dipendente i polipeptidi (GIP) vengono rilasciati dall'intestino durante il giorno e i livelli aumentano in risposta ad un pasto. Questi ormoni vengono rapidamente inattivati dall'enzima DPP-4. Le incretine fanno parte di un sistema endogeno coinvolto nella regolazione fisiologica dell'omeostasi del glucosio. Quando le concentrazioni di glucosio nel sangue sono normali o elevate, GLP-1 e GIP aumentano la sintesi di insulina e il rilascio dalle cellule beta del pancreas attraverso vie di segnalazione intracellulari che coinvolgono AMP ciclico. Il GLP-1 riduce anche la secrezione di glucagone dalle cellule alfa pancreatiche, portando a una ridotta produzione di glucosio epatico. Aumentando e prolungando i livelli di incretina attiva, sitagliptin aumenta il rilascio di insulina e diminuisce i livelli di glucagone nella circolazione in modo glucosio-dipendente. Sitagliptin dimostra selettività per DPP-4 e non inibisce l'attività di DPP-8 o DPP-9 in vitro a concentrazioni approssimate a dosi terapeutiche.
Metformina cloridrato
La metformina è un agente antiiperglicemico che migliora la tolleranza al glucosio nei pazienti con diabete di tipo 2, riducendo il glucosio plasmatico basale e postprandiale. I suoi meccanismi di azione farmacologica sono diversi dalle altre classi di agenti antiiperglicemici orali. La metformina riduce la produzione di glucosio epatico, diminuisce l'assorbimento intestinale di glucosio e migliora la sensibilità all'insulina aumentando l'assorbimento e l'utilizzo periferici del glucosio. A differenza delle sulfoniluree, la metformina non produce ipoglicemia in entrambi i pazienti con diabete di tipo 2 o in soggetti normali (tranne in circostanze speciali [vedere Avvertenze e precauzioni]) e non causa iperinsulinemia. Con la terapia con metformina, la secrezione di insulina rimane invariata mentre i livelli di insulina a digiuno e la risposta plasmatica di insulina durante il giorno possono effettivamente diminuire.
12.2 Farmacodinamica
sitagliptin
Generale
Nei pazienti con diabete di tipo 2, la somministrazione di sitagliptin ha portato all'inibizione dell'attività dell'enzima DPP-4 per un periodo di 24 ore. Dopo un carico di glucosio orale o un pasto, questa inibizione del DPP-4 ha provocato un aumento da 2 a 3 volte dei livelli circolanti di GLP-1 attivo e GIP, diminuzione delle concentrazioni di glucagone e aumento della reattività del rilascio di insulina al glucosio, con conseguente aumento del peptide C e dell'insulina concentrazioni. L'aumento dell'insulina con la diminuzione del glucagone era associato a concentrazioni di glucosio a digiuno più basse e riduzione dell'escursione di glucosio a seguito di un carico di glucosio orale o di un pasto.
Co-somministrazione di sitagliptin e metformina cloridrato
In uno studio di due giorni su soggetti sani, sitagliptin da solo ha aumentato le concentrazioni di GLP-1 attive, mentre la sola metformina ha aumentato le concentrazioni di GLP-1 attive e totali in misura simile. La co-somministrazione di sitagliptin e metformina ha avuto un effetto aggiuntivo sulle concentrazioni attive di GLP-1. Sitagliptin, ma non metformina, ha aumentato le concentrazioni di GIP attive. Non è chiaro cosa significano questi risultati per i cambiamenti nel controllo glicemico nei pazienti con diabete di tipo 2.
Negli studi con soggetti sani, sitagliptin non ha abbassato la glicemia né ha causato ipoglicemia.
Elettrofisiologia cardiaca
In uno studio crossover randomizzato, controllato con placebo, a 79 soggetti sani è stata somministrata una singola dose orale di sitagliptin 100 mg, sitagliptin 800 mg (8 volte la dose raccomandata) e placebo. Alla dose raccomandata di 100 mg, non vi è stato alcun effetto sull'intervallo QTc ottenuto alla massima concentrazione plasmatica o in qualsiasi altro momento durante lo studio. Dopo la dose di 800 mg, l'aumento massimo della variazione media corretta del placebo nel QTc rispetto al basale a 3 ore dopo la dose era di 8,0 msec. Questo aumento non è considerato clinicamente significativo. Alla dose di 800 mg, le concentrazioni plasmatiche di picco di sitagliptin erano circa 11 volte superiori alle concentrazioni di picco dopo una dose di 100 mg.
Nei pazienti con diabete di tipo 2, sitagliptin 100 mg (N = 81) o sitagliptin 200 mg (N = 63) al giorno non sono state apportate modifiche significative all'intervallo QTc in base ai dati ECG ottenuti al momento del picco plasmatico atteso concentrazione.
farmacocinetica
Janumet
I risultati di uno studio di bioequivalenza in soggetti sani hanno dimostrato che Janumet (sitagliptin / metformin HCl) 50 mg / 500 mg e 50 mg / 1000 mg compresse combinate sono bioequivalenti alla co-somministrazione di dosi corrispondenti di sitagliptin (JANUVIA™2) e metformina cloridrato in compresse individuali.
Assorbimento
sitagliptin
La biodisponibilità assoluta di sitagliptin è di circa l'87%. La co-somministrazione di un pasto ricco di grassi con sitagliptin non ha avuto effetti sulla farmacocinetica di sitagliptin.
Metformina cloridrato
La biodisponibilità assoluta di una compressa di metformina cloridrato da 500 mg somministrata a digiuno è di circa il 50-60%. Studi condotti con dosi orali singole di compresse di metformina cloridrato da 500 mg a 1500 mg e da 850 mg a 2550 mg indicano che esiste una mancanza di proporzionalità della dose all'aumentare delle dosi, dovuta alla riduzione dell'assorbimento piuttosto che a un'alterazione nell'eliminazione. Il cibo diminuisce l'estensione e ritarda leggermente l'assorbimento della metformina, come mostrato da una concentrazione plasmatica media di picco inferiore di circa il 40% (Cmax), un'area inferiore del 25% al di sotto della concentrazione plasmatica rispetto alla curva del tempo (AUC) e un prolungamento di 35 minuti del tempo al picco della concentrazione plasmatica (Tmax) a seguito della somministrazione di una singola compressa da 850 mg di metformina con il cibo, rispetto alla stessa dose di compresse somministrata a digiuno. La rilevanza clinica di queste diminuzioni non è nota.
Distribuzione
sitagliptin
Il volume medio di distribuzione allo stato stazionario dopo una singola dose endovenosa da 100 mg di sitagliptin in soggetti sani è di circa 198 litri. La frazione di sitagliptin legata in modo reversibile alle proteine plasmatiche è bassa (38%).
Metformina cloridrato
Il volume apparente di distribuzione (V / F) della metformina a seguito di singole dosi orali di compresse di metformina cloridrato 850 mg è stato in media 654 ± 358 L. La metformina è legata in modo trascurabile alle proteine plasmatiche, a differenza delle sulfoniluree, che sono legate per oltre il 90% alle proteine. La metformina si divide in eritrociti, molto probabilmente in funzione del tempo. Alle normali dosi cliniche e ai programmi di dosaggio delle compresse di metformina cloridrato, le concentrazioni plasmatiche di metformina allo stato stazionario vengono raggiunte entro 24-48 ore e sono generalmente
Metabolismo
sitagliptin
Circa il 79% di sitagliptin viene escreto immodificato nelle urine con il metabolismo che rappresenta una via minore di eliminazione.
A seguito di un [14C] dose orale di sitagliptin, circa il 16% della radioattività è stata escreta sotto forma di metaboliti di sitagliptin. Sei metaboliti sono stati rilevati a livelli di tracce e non si prevede che contribuiscano all'attività inibitoria plasmatica di DPP-4 di sitagliptin. Studi in vitro hanno indicato che l'enzima primario responsabile del metabolismo limitato di sitagliptin era il CYP3A4, con il contributo del CYP2C8.
Metformina cloridrato
Gli studi per dose singola endovenosa in soggetti normali dimostrano che la metformina viene escreta immodificata nel urina e non subisce metabolismo epatico (nessun metabolita è stato identificato nell'uomo) né biliare escrezione.
Escrezione
sitagliptin
A seguito di somministrazione di un orale [14C] dose di sitagliptin in soggetti sani, circa il 100% della radioattività somministrata è stata eliminata nelle feci (13%) o nelle urine (87%) entro una settimana dalla somministrazione. L'apparente terminale t1/2 dopo una dose orale di sitagliptin di 100 mg è stata di circa 12,4 ore e la clearance renale è stata di circa 350 ml / min.
L'eliminazione di sitagliptin si verifica principalmente attraverso l'escrezione renale e comporta una secrezione tubulare attiva. Sitagliptin è un substrato per il trasportatore di anioni organici umani 3 (hOAT-3), che può essere coinvolto nell'eliminazione renale di sitagliptin. La rilevanza clinica di hOAT-3 nel trasporto di sitagliptin non è stata stabilita. Sitagliptin è anche un substrato della glicoproteina p, che può anche essere coinvolto nella mediazione dell'eliminazione renale di sitagliptin. Tuttavia, la ciclosporina, un inibitore della glicoproteina p, non ha ridotto la clearance renale di sitagliptin.
Metformina cloridrato
La clearance renale è circa 3,5 volte maggiore della clearance della creatinina, il che indica che la secrezione tubulare è la principale via di eliminazione della metformina. Dopo somministrazione orale, circa il 90% del farmaco assorbito viene eliminato per via renale entro le prime 24 ore, con un'emivita di eliminazione plasmatica di circa 6,2 ore. Nel sangue, l'emivita di eliminazione è di circa 17,6 ore, suggerendo che la massa eritrocitaria può essere un compartimento di distribuzione.
Popolazioni speciali
Insufficienza renale
Janumet
Janumet non deve essere usato in pazienti con insufficienza renale [vedere Controindicazioni; Avvertenze e precauzioni].
sitagliptin
È stato osservato un aumento di circa 2 volte dell'AUC plasmatica di sitagliptin in pazienti con insufficienza renale moderata e circa 4 volte è stato osservato un aumento nei pazienti con grave insufficienza renale inclusi i pazienti con ESRD in emodialisi, rispetto al normale controllo sano soggetti.
Metformina cloridrato
In pazienti con ridotta funzionalità renale (in base alla clearance della creatinina misurata), emivita plasmatica e ematica di metformina è prolungata e la clearance renale è ridotta in proporzione alla diminuzione della creatinina spazio.
Insufficienza epatica
sitagliptin
Nei pazienti con insufficienza epatica moderata (punteggio di Child-Pugh da 7 a 9), indicare AUC e Cmax di sitagliptin è aumentato di circa il 21% e il 13%, rispettivamente, rispetto ai controlli sani associati dopo la somministrazione di una singola dose da 100 mg di sitagliptin. Queste differenze non sono considerate clinicamente significative.
Non esiste esperienza clinica in pazienti con grave insufficienza epatica (punteggio di Child-Pugh> 9).
Metformina cloridrato
Non sono stati condotti studi di farmacocinetica sulla metformina in pazienti con insufficienza epatica.
Genere
sitagliptin
Il genere non ha avuto effetti clinicamente significativi sulla farmacocinetica di sitagliptin in base a un composto analisi dei dati di farmacocinetica di Fase I e su un'analisi farmacocinetica di popolazione di Fase I e Fase II dati.
Metformina cloridrato
I parametri farmacocinetici della metformina non differivano significativamente tra soggetti normali e pazienti con diabete di tipo 2 quando analizzati in base al sesso. Allo stesso modo, negli studi clinici controllati su pazienti con diabete di tipo 2, l'effetto anti-iperglicemico della metformina era comparabile negli uomini e nelle donne.
geriatrico
sitagliptin
Quando si tiene conto degli effetti dell'età sulla funzione renale, l'età da sola non ha avuto un effetto clinico impatto significativo sulla farmacocinetica di sitagliptin in base a una farmacocinetica di popolazione analisi. I soggetti anziani (da 65 a 80 anni) avevano concentrazioni plasmatiche di sitagliptin circa il 19% più elevate rispetto ai soggetti più giovani.
Metformina cloridrato
Dati limitati provenienti da studi farmacocinetici controllati sulla metformina in soggetti anziani sani suggeriscono che la clearance plasmatica totale della metformina è ridotta, l'emivita è prolungata e Cmax è aumentato, rispetto ai soggetti giovani sani. Da questi dati, sembra che il cambiamento nella farmacocinetica della metformina con l'invecchiamento sia principalmente dovuto a un cambiamento della funzionalità renale (vedi GLUCOPHAGE3 informazioni di prescrizione: FARMACOLOGIA CLINICA, Popolazioni speciali, Geriatria).
Il trattamento con Janumet non deve essere iniziato in pazienti di età 80 80 anni a meno che la misurazione della clearance della creatinina non dimostri che la funzionalità renale non è ridotta [vedere Avvertenze e precauzioni].
pediatrico
Non sono stati condotti studi con Janumet in pazienti pediatrici.
Gara
sitagliptin
La razza non ha avuto effetti clinicamente significativi sulla farmacocinetica di sitagliptin sulla base di un'analisi composita dei dati di farmacocinetica disponibili, inclusi soggetti di razza bianca, ispanica, nera, asiatica e di altro tipo gruppi.
Metformina cloridrato
Non sono stati condotti studi sui parametri farmacocinetici della metformina in base alla razza. Negli studi clinici controllati sulla metformina in pazienti con diabete di tipo 2, l'effetto antiiperglicemico è stato comparabile nei bianchi (n = 249), nei neri (n = 51) e negli ispanici (n = 24).
Indice di massa corporea (BMI)
sitagliptin
L'indice di massa corporea non ha avuto effetti clinicamente significativi sulla farmacocinetica di sitagliptin in base a un composto analisi dei dati di farmacocinetica di Fase I e su un'analisi farmacocinetica di popolazione di Fase I e Fase II dati.
Interazioni farmacologiche
Sitagliptin e metformina cloridrato
La co-somministrazione di dosi multiple di sitagliptin (50 mg) e metformina (1000 mg) somministrata due volte al giorno ha fatto non alterare in modo significativo la farmacocinetica di sitagliptin o metformina in pazienti con tipo 2 diabete.
Non sono stati condotti studi di interazione farmacocinetica con Janumet; tuttavia, tali studi sono stati condotti con i singoli componenti di Janumet (sitagliptin e metformina cloridrato).
sitagliptin
Valutazione in vitro delle interazioni farmacologiche
Sitagliptin non è un inibitore degli isozimi del CYP CYP3A4, 2C8, 2C9, 2D6, 1A2, 2C19 o 2B6 e non è un induttore del CYP3A4. Sitagliptin è un substrato della p-glicoproteina, ma non inibisce il trasporto mediato dalla digossina della p-glicoproteina. Sulla base di questi risultati, è improbabile che sitagliptin causi interazioni con altri farmaci che utilizzano questi percorsi.
Sitagliptin non è ampiamente legato alle proteine plasmatiche. Pertanto, la propensione di sitagliptin a essere coinvolto in interazioni farmaco-farmaco clinicamente significative mediate dallo spostamento del legame con le proteine plasmatiche è molto bassa.
Valutazione in vivo delle interazioni farmacologiche
Effetto di Sitagliptin su altri farmaci
Negli studi clinici, come descritto di seguito, sitagliptin non ha alterato significativamente la farmacocinetica di metformina, glyburide, simvastatina, rosiglitazone, warfarin o orale contraccettivi, che forniscono prove in vivo di una bassa propensione a causare interazioni farmacologiche con substrati di CYP3A4, CYP2C8, CYP2C9 e trasportatore cationico organico (OCT).
Digossina: Sitagliptin ha avuto un effetto minimo sulla farmacocinetica della digossina. Dopo la somministrazione di 0,25 mg di digossina in concomitanza con 100 mg di sitagliptin al giorno per 10 giorni, l'AUC plasmatica della digossina è stata aumentata dell'11% e il plasma Cmax del 18%.
Sulfoniluree: la farmacocinetica monodose di glyburide, un substrato del CYP2C9, non è stata significativamente alterata nei soggetti che hanno ricevuto dosi multiple di sitagliptin. Non si prevedono interazioni clinicamente significative con altre sulfoniluree (ad es. Glipizide, tolbutamide e glimepiride) che, come la glicburide, vengono principalmente eliminate dal CYP2C9 [vedi Avvertenze e precauzioni].
Simvastatina: la farmacocinetica monodose di simvastatina, un substrato del CYP3A4, non è stata alterata in modo significativo nei soggetti che hanno ricevuto dosi giornaliere multiple di sitagliptin. Pertanto, sitagliptin non è un inibitore del metabolismo mediato dal CYP3A4.
Tiazolidinedioni: la farmacocinetica monodose di rosiglitazone non è stata significativamente modificata nei soggetti ricevere dosi giornaliere multiple di sitagliptin, indicando che sitagliptin non è un inibitore del CYP2C8-mediato metabolismo.
Warfarin: dosi giornaliere multiple di sitagliptin non hanno alterato significativamente la farmacocinetica, come valutato dalla misurazione di Enantiomeri S (-) o R (+) warfarin, o farmacodinamica (come valutato dalla misurazione della protrombina INR) di una singola dose di warfarin. Poiché S (-) warfarin è principalmente metabolizzato dal CYP2C9, questi dati supportano anche la conclusione che sitagliptin non è un inibitore del CYP2C9.
Contraccettivi orali: la co-somministrazione con sitagliptin non ha alterato significativamente la farmacocinetica allo stato stazionario di noretindrone o etinilestradiolo.
Effetto di altri farmaci su Sitagliptin
I dati clinici descritti di seguito suggeriscono che sitagliptin non è suscettibile di interazioni clinicamente significative da parte di farmaci somministrati in concomitanza.
Ciclosporina: è stato condotto uno studio per valutare l'effetto della ciclosporina, un potente inibitore della glicoproteina p, sulla farmacocinetica di sitagliptin. La co-somministrazione di una singola dose orale di sitagliptin da 100 mg e una singola dose orale di ciclosporina da 600 mg ha aumentato l'AUC e la Cmax di sitagliptin di circa il 29% e il 68%, rispettivamente. Questi modesti cambiamenti nella farmacocinetica di sitagliptin non sono stati considerati clinicamente significativi. Anche la clearance renale di sitagliptin non è stata alterata in modo significativo. Pertanto, non si prevedono interazioni significative con altri inibitori della p-glicoproteina.
Metformina cloridrato
[Vedere Interazioni farmacologiche]
superiore
Tossicologia non clinica
Cancerogenesi, mutagenesi, alterazione della fertilità
Janumet
Non sono stati condotti studi sugli animali con i prodotti combinati di Janumet per valutare la carcinogenesi, la mutagenesi o la compromissione della fertilità. I seguenti dati si basano sui risultati degli studi con sitagliptin e metformina singolarmente.
sitagliptin
È stato condotto uno studio di carcinogenicità di due anni su ratti maschi e femmine trattati con dosi orali di sitagliptin di 50, 150 e 500 mg / kg / die. C'è stata un'aumentata incidenza di adenoma / carcinoma epatico combinato nei maschi e nelle femmine e di carcinoma epatico nelle femmine a 500 mg / kg. Questa dose determina esposizioni circa 60 volte l'esposizione umana alla dose massima giornaliera raccomandata nell'uomo adulto (MRHD) di 100 mg / giorno sulla base dei confronti dell'AUC. I tumori epatici non sono stati osservati a 150 mg / kg, circa 20 volte l'esposizione umana alla MRHD. È stato condotto uno studio di carcinogenicità di due anni su topi maschi e femmine trattati con dosi orali di sitagliptin di 50, 125, 250 e 500 mg / kg / giorno. Non vi è stato alcun aumento dell'incidenza di tumori in nessun organo fino a 500 mg / kg, circa 70 volte l'esposizione umana alla MRHD. Sitagliptin non è risultato mutageno o clastogenico con o senza attivazione metabolica nel test di mutagenicità batterica di Ames, ovaio di criceto cinese (CHO) test di aberrazione cromosomica, test di citogenetica in vitro in CHO, test di eluizione alcalina del DNA degli epatociti di ratto in vitro e micronucleo in vivo dosaggio.
Negli studi sulla fertilità nel ratto con dosi di gavage orali di 125, 250 e 1000 mg / kg, i maschi sono stati trattati per 4 settimane prima dell'accoppiamento, durante accoppiamento, fino alla conclusione programmata (circa 8 settimane in totale) e le femmine sono state trattate 2 settimane prima dell'accoppiamento attraverso la gestazione giorno 7 Non sono stati osservati effetti avversi sulla fertilità a 125 mg / kg (circa 12 volte l'esposizione umana alla MRHD di 100 mg / giorno sulla base dei confronti dell'AUC). A dosi più elevate, sono stati osservati aumenti maggiori di riassorbimento correlati alla non dose nelle femmine (circa 25 e 100 volte l'esposizione umana alla MRHD sulla base del confronto con l'AUC).
Metformina cloridrato
Sono stati condotti studi di carcinogenicità a lungo termine nei ratti (durata della somministrazione di 104 settimane) e nei topi (durata della dose di 91 settimane) a dosi fino a 900 mg / kg / giorno e 1500 mg / kg / giorno inclusi, rispettivamente. Queste dosi sono entrambe circa quattro volte la dose giornaliera massima raccomandata nell'uomo di 2000 mg sulla base dei confronti della superficie corporea. Nessuna prova di cancerogenicità con metformina è stata trovata in topi maschi o femmine. Allo stesso modo, non è stato osservato potenziale tumorigenico con metformina nei ratti maschi. Vi è stata, tuttavia, un'aumentata incidenza di polipi uterini stromali benigni nei ratti trattati con 900 mg / kg / die.
Non ci sono prove di un potenziale mutageno della metformina nei seguenti test in vitro: test di Ames (S. typhimurium), test di mutazione genica (cellule di linfoma di topo) o test di aberrazioni cromosomiche (linfociti umani). Anche i risultati del test del micronucleo su topo in vivo erano negativi. La fertilità di ratti maschi o femmine non è stata influenzata dalla metformina quando somministrato a dosi fino a 600 mg / kg / die, che è circa tre volte la dose massima giornaliera raccomandata nell'uomo in base alla superficie corporea confronti.
superiore
Studi clinici
La co-somministrazione di sitagliptin e metformina è stata studiata in pazienti con diabete di tipo 2 non adeguatamente controllati con dieta ed esercizio fisico e in associazione con glimepiride.
Non sono stati condotti studi di efficacia clinica con Janumet; tuttavia, è stata dimostrata la bioequivalenza di Janumet con sitagliptin e metformina cloridrato somministrati in concomitanza.
Co-somministrazione di sitagliptin e metformina in pazienti con diabete di tipo 2 non adeguatamente controllati con dieta ed esercizio fisico
Un totale di 1091 pazienti con diabete di tipo 2 e controllo glicemico inadeguato su dieta ed esercizio fisico hanno partecipato a una settimana di 24 settimane, studio fattoriale randomizzato, in doppio cieco, controllato con placebo, progettato per valutare l'efficacia di sitagliptin e metformina co-somministrazione. I pazienti che assumevano un agente antiiperglicemico (N = 541) sono stati sottoposti a dieta, esercizio fisico e periodo di sospensione della terapia della durata massima di 12 settimane. Dopo il periodo di washout, i pazienti con controllo glicemico inadeguato (dal A1C al 7,5% all'11%) sono stati randomizzati dopo aver completato un periodo di rodaggio placebo in cieco di 2 settimane. Pazienti non trattati con agenti antiiperglicemici all'ingresso nello studio (N = 550) con controllo glicemico inadeguato (A1C Dal 7,5% all'11%) entrarono immediatamente nel periodo di rodaggio del placebo in cieco di 2 settimane e poi lo furono randomizzato. Un numero approssimativamente uguale di pazienti è stato randomizzato a ricevere placebo, 100 mg di sitagliptin una volta al giorno, 500 mg o 1000 mg di metformina due volte al giorno o 50 mg di sitagliptin due volte al giorno in associazione con 500 mg o 1000 mg di metformina due volte quotidiano. I pazienti che non hanno raggiunto specifici obiettivi glicemici durante lo studio sono stati trattati con salvataggio in glyburide (glibenclamide).
La somministrazione concomitante di sitagliptin e metformina ha fornito miglioramenti significativi in A1C, FPG e PPG di 2 ore rispetto al placebo, alla sola metformina e alla sola sitagliptin (Tabella 3, Figura 1). Le riduzioni medie dal basale in A1C erano generalmente maggiori per i pazienti con valori A1C al basale più elevati. Per i pazienti che non assumevano un agente antiiperglicemico all'ingresso nello studio, le riduzioni medie dal basale in A1C erano: sitagliptin 100 mg una volta al giorno, -1,1%; metformina 500 mg bid, -1,1%; metformina offerta da 1000 mg, -1,2%; sitagliptin 50 mg bid con metformin 500 mg bid, -1,6%; sitagliptin 50 mg bid con metformin bid 1000 bid, -1,9%; e per i pazienti trattati con placebo, -0,2%. Gli effetti dei lipidi erano generalmente neutri. La riduzione del peso corporeo nei gruppi trattati con sitagliptin in associazione con metformina era simile a quella dei gruppi trattati con metformina da sola o con placebo.
Tabella 3: parametri glicemici alla visita finale (studio di 24 settimane) per Sitagliptin e metformina, da soli e in associazione in pazienti con diabete di tipo 2 non adeguatamente controllati con dieta ed esercizio fisico *
Placebo |
sitagliptin 100 mg QD |
Metformina Offerta da 500 mg |
Metformina Offerta da 1000 mg |
sitagliptin 50 mg di offerta + Metformina Offerta da 500 mg |
sitagliptin 50 mg di offerta + Metformina Offerta da 1000 mg |
|
| ||||||
| A1C (%) | N = 165 | N = 175 | N = 178 | N = 177 | N = 183 | N = 178 |
| Linea di base (media) | 8.7 | 8.9 | 8.9 | 8.7 | 8.8 | 8.8 |
| Variazione rispetto al basale (media corretta†) | 0.2 | -0.7 | -0.8 | -1.1 | -1.4 | -1.9 |
| Differenza rispetto al placebo (media aggiustata†) (IC al 95%) |
-0.8c (-1.1, -0.6) |
-1.0c (-1.2, -0.8) |
-1.3c (-1.5, -1.1) |
-1.6c (-1.8, -1.3) |
-2.1c (-2.3, -1.8) |
|
| Pazienti (%) che hanno raggiunto A1C <7% | 15 (9%) | 35 (20%) | 41 (23%) | 68 (38%) | 79 (43%) | 118 (66%) |
| % Pazienti che ricevono farmaci di salvataggio | 32 | 21 | 17 | 12 | 8 | 2 |
| FPG (mg / dL) | N = 169 | N = 178 | N = 179 | N = 179 | N = 183 | N = 180 |
| Linea di base (media) | 196 | 201 | 205 | 197 | 204 | 197 |
| Variazione rispetto al basale (media corretta†) | 6 | -17 | -27 | -29 | -47 | -64 |
| Differenza rispetto al placebo (media aggiustata†) (IC al 95%) |
-23c (-33, -14) |
-33c (-43, -24) |
-35c (-45, -26) |
-53c (-62, -43) |
-70c (-79, -60) |
|
| PPG di 2 ore (mg / dL) | N = 129 | N = 136 | N = 141 | N = 138 | N = 147 | N = 152 |
| Linea di base (media) | 277 | 285 | 293 | 283 | 292 | 287 |
| Variazione rispetto al basale (media corretta†) | 0 | -52 | -53 | -78 | -93 | -117 |
| Differenza rispetto al placebo (media aggiustata†) (IC al 95%) |
-52c (-67, -37) |
-54c (-69, -39) |
-78c (-93, -63) |
-93c (-107, -78) |
-117c (-131, -102) |
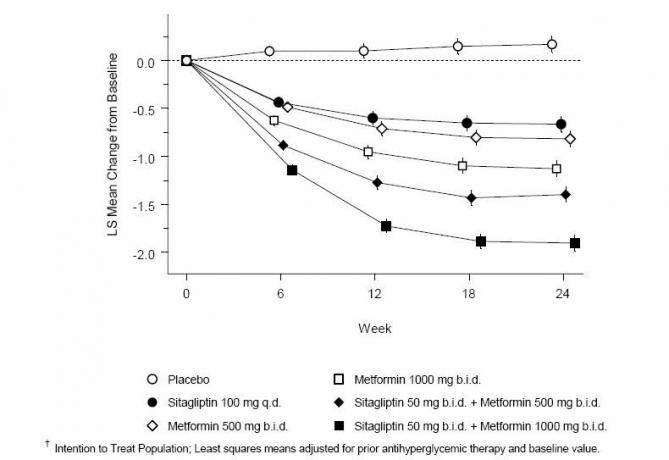
Figura 1: variazione media rispetto al basale per A1C (%) in 24 settimane con Sitagliptin e Metformin, Alone e in combinazione in pazienti con diabete di tipo 2 inadeguatamente controllati con dieta ed esercizio fisicoâ €
Inoltre, questo studio ha incluso pazienti (N = 117) con iperglicemia più grave (A1C> 11% o sangue glucosio> 280 mg / dL) che sono stati trattati con sitagliptin 50 mg e metformina 1000 in aperto due volte al giorno mg. In questo gruppo di pazienti, il valore medio di A1C al basale era dell'11,2%, l'FPG medio era di 314 mg / dL e la PPG media a 2 ore era di 441 mg / dL. Dopo 24 settimane, sono state osservate riduzioni medie dal basale del -2,9% per A1C, -127 mg / dL per FPG e -208 mg / dL per PPG di 2 ore.
La terapia di combinazione iniziale o il mantenimento della terapia di combinazione devono essere personalizzati e lasciati alla discrezione del fornitore di assistenza sanitaria.
Terapia aggiuntiva con Sitagliptin in pazienti con diabete di tipo 2 non adeguatamente controllati con metformina da sola
Un totale di 701 pazienti con diabete di tipo 2 hanno partecipato a uno studio di 24 settimane, randomizzato, in doppio cieco, controllato con placebo, progettato per valutare l'efficacia di sitagliptin in associazione con metformina. I pazienti già trattati con metformina (N = 431) ad una dose di almeno 1500 mg al giorno sono stati randomizzati dopo aver completato un periodo di rodaggio placebo in cieco di 2 settimane. Pazienti trattati con metformina e un altro agente antiiperglicemico (N = 229) e pazienti che non assumono alcun agente antiiperglicemico (interruzione della terapia per almeno 8 settimane, N = 41) sono stati randomizzati dopo un periodo di rodaggio di circa 10 settimane con metformina (ad una dose di almeno 1500 mg al giorno) in monoterapia. I pazienti sono stati randomizzati all'aggiunta di 100 mg di sitagliptin o placebo, somministrati una volta al giorno. I pazienti che non hanno raggiunto specifici obiettivi glicemici durante gli studi sono stati trattati con il salvataggio di pioglitazone.
In combinazione con metformina, sitagliptin ha fornito miglioramenti significativi in A1C, FPG e PPG di 2 ore rispetto al placebo con metformina (Tabella 4). La terapia glicemica di salvataggio è stata utilizzata nel 5% dei pazienti trattati con sitagliptin 100 mg e nel 14% dei pazienti trattati con placebo. Una simile riduzione del peso corporeo è stata osservata per entrambi i gruppi di trattamento.
Tabella 4: parametri glicemici alla visita finale (studio di 24 settimane) di Sitagliptin nella terapia di associazione aggiuntiva con metformina *
| Sitagliptin 100 mg QD + Metformina |
Placebo + Metformina |
|
| ||
| A1C (%) | N = 453 | N = 224 |
| Linea di base (media) | 8.0 | 8.0 |
| Variazione rispetto al basale (media corretta†) | -0.7 | -0.0 |
| Differenza rispetto al placebo + metformina (media aggiustata†) (IC al 95%) |
-0.7c (-0.8, -0.5) |
|
| Pazienti (%) che hanno raggiunto A1C <7% | 213 (47%) | 41 (18%) |
| FPG (mg / dL) | N = 454 | N = 226 |
| Linea di base (media) | 170 | 174 |
| Variazione rispetto al basale (media corretta†) | -17 | 9 |
| Differenza rispetto al placebo + metformina (media aggiustata†) (IC al 95%) |
-25c (-31, -20) |
|
| PPG di 2 ore (mg / dL) | N = 387 | N = 182 |
| Linea di base (media) | 275 | 272 |
| Variazione rispetto al basale (media corretta†) | -62 | -11 |
| Differenza rispetto al placebo + metformina (media aggiustata†) (IC al 95%) |
-51c (-61, -41) |
Terapia aggiuntiva con Sitagliptin in pazienti con diabete di tipo 2 non adeguatamente controllati dalla combinazione di metformina e glimepiride
Un totale di 441 pazienti con diabete di tipo 2 hanno partecipato a un trattamento di 24 settimane, randomizzato, in doppio cieco, studio controllato con placebo progettato per valutare l'efficacia di sitagliptin in associazione con glimepiride, con o senza metformina. I pazienti sono entrati in un periodo di rodaggio con glimepiride (â ‰ ¥ 4 mg al giorno) da soli o glimepiride in associazione con metformina (â ‰ ¥ 1500 mg al giorno). Dopo una titolazione della dose e un periodo di rodaggio dose-stabile fino a 16 settimane e un periodo di rodaggio placebo di 2 settimane, i pazienti con inadeguata il controllo glicemico (da A1C 7,5% a 10,5%) è stato randomizzato all'aggiunta di 100 mg di sitagliptin o placebo, somministrati una volta quotidiano. I pazienti che non hanno raggiunto specifici obiettivi glicemici durante gli studi sono stati trattati con il salvataggio di pioglitazone.
I pazienti trattati con sitagliptin con metformina e glimepiride hanno mostrato miglioramenti significativi in A1C e FPG rispetto ai pazienti trattati placebo con metformina e glimepiride (Tabella 5), con riduzioni medie dal basale rispetto al placebo in A1C di -0,9% e in FPG di -21 mg / dL. La terapia di salvataggio è stata utilizzata nell'8% dei pazienti trattati con sitagliptin 100 mg e nel 29% dei pazienti trattati con placebo aggiuntivo. I pazienti trattati con sitagliptin aggiuntivo hanno avuto un aumento medio del peso corporeo di 1,1 kg vs. placebo aggiuntivo (+0,4 kg vs. -0,7 kg). Inoltre, sitagliptin aggiuntivo ha comportato un aumento del tasso di ipoglicemia rispetto al placebo aggiuntivo. [Vedere Avvertenze e precauzioni; Reazioni avverse.]
Tabella 5: parametri glicemici alla visita finale (studio di 24 settimane) per Sitagliptin in combinazione con metformina e glimepiride *
| Sitagliptin 100 mg + Metformina e Glimepiride |
Placebo + Metformina e Glimepiride |
|
| ||
| A1C (%) | N = 115 | N = 105 |
| Linea di base (media) | 8.3 | 8.3 |
| Variazione rispetto al basale (media corretta†) | -0.6 | 0.3 |
| Differenza rispetto al placebo (media aggiustata†) (IC al 95%) | -0.9c (-1.1, -0.7) |
|
| Pazienti (%) che hanno raggiunto A1C <7% | 26 (23%) | 1 (1%) |
| FPG (mg / dL) | N = 115 | N = 109 |
| Linea di base (media) | 179 | 179 |
| Variazione rispetto al basale (media corretta†) | -8 | 13 |
| Differenza rispetto al placebo (media aggiustata†) (IC al 95%) | -21c (-32, -10) |
Terapia aggiuntiva Sitagliptin vs. Terapia aggiuntiva di Glipizide in pazienti con diabete di tipo 2 non adeguatamente controllati con metformina
L'efficacia di sitagliptin è stata valutata in uno studio di non inferiorità di 52 settimane, in doppio cieco, controllato con glipizide, in pazienti con diabete di tipo 2. I pazienti non in trattamento o con altri agenti antiiperglicemici hanno iniziato un periodo di rodaggio fino a 12 settimane con metformina in monoterapia (dose di ¥ 1500 mg al giorno) che includeva il lavaggio di farmaci diversi dalla metformina, se applicabile. Dopo il periodo di rodaggio, quelli con controllo glicemico inadeguato (A1C dal 6,5% al 10%) sono stati randomizzati 1: 1 all'aggiunta di sitagliptin 100 mg una volta al giorno o glipizide per 52 settimane. Ai pazienti in trattamento con glipizide è stato somministrato un dosaggio iniziale di 5 mg / die e successivamente titolato elettivamente per le successive 18 settimane a un dosaggio massimo di 20 mg / die, se necessario per ottimizzare il controllo glicemico. Successivamente, la dose di glipizide doveva essere mantenuta costante, ad eccezione della titolazione ridotta per prevenire l'ipoglicemia. La dose media di glipizide dopo il periodo di titolazione era di 10 mg.
Dopo 52 settimane, sitagliptin e glipizide hanno mostrato riduzioni medie simili rispetto al basale in A1C nell'analisi intent-to-treat (Tabella 6). Questi risultati erano coerenti con l'analisi per protocollo (Figura 2). Una conclusione a favore della non inferiorità di sitagliptin rispetto a glipizide può essere limitata ai pazienti con basale A1C paragonabile a quelli inclusi nello studio (oltre il 70% dei pazienti aveva A1C basale <8% e oltre il 90% aveva A1C <9%).
Tabella 6: Parametri glicemici in uno studio di 52 settimane che confronta Sitagliptin con Glipizide come terapia aggiuntiva nei pazienti non adeguatamente controllati con metformina (popolazione intent-to-treat) *
| Sitagliptin 100 mg + Metformina |
Glipizide + Metformina |
|
| ||
| A1C (%) | N = 576 | N = 559 |
| Linea di base (media) | 7.7 | 7.6 |
| Variazione rispetto al basale (media corretta†) | -0.5 | -0.6 |
| FPG (mg / dL) | N = 583 | N = 568 |
| Linea di base (media) | 166 | 164 |
| Variazione rispetto al basale (media corretta†) | -8 | -8 |
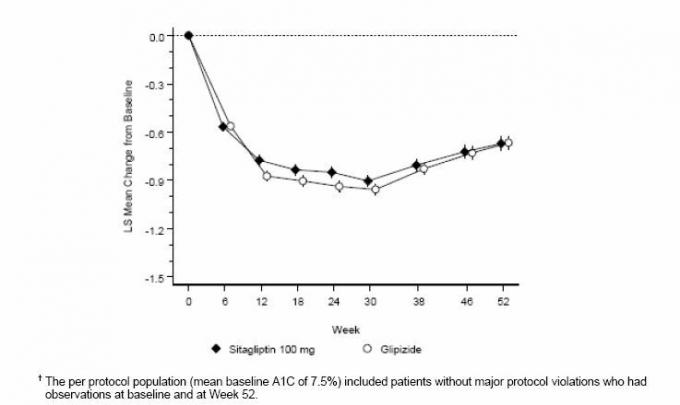
Figura 2: Variazione media rispetto al basale per A1C (%) in 52 settimane in uno studio confrontando Sitagliptin con Glipizide come terapia aggiuntiva nei pazienti non adeguatamente controllati con metformina (popolazione per protocollo) â€
L'incidenza di ipoglicemia nel gruppo sitagliptin (4,9%) era significativamente (p <0,001) inferiore a quella nel gruppo glipizide (32,0%). I pazienti trattati con sitagliptin hanno mostrato una riduzione media significativa rispetto al basale del peso corporeo rispetto a un aumento di peso significativo nei pazienti a cui è stata somministrata glipizide (-1,5 kg vs. +1,1 kg).
superiore
Come fornito
N. 6747 - Le compresse di Janumet, 50 mg / 500 mg, sono compresse di colore rosa chiaro, a forma di capsula, rivestite con film con "575" inciso su un lato. Sono forniti come segue:
NDC 0006-0575-61 flaconi da 60 unità
NDC 0006-0575-62 flaconi da 180 unità
NDC 0006-0575-52 blister dose unitaria da 50
NDC 0006-0575-82 flaconi sfusi da 1000.
N. 6749 - Compresse Janumet, 50 mg / 1000 mg, sono compresse rivestite con film rosse, a forma di capsula, con impresso "577" su un lato. Sono forniti come segue:
NDC 0006-0577-61 flaconi da 60 unità
NDC 0006-0577-62 flaconi da 180 unità
NDC 0006-0577-52 blister dose unitaria da 50
NDC 0006-0577-82 flaconi sfusi da 1000.
Conservare a 20-25 ° C (68-77 ° F), escursioni consentite a 15-30 ° C (59-86 ° F).
superiore
Informazioni sulla consulenza al paziente
Istruzioni
I pazienti devono essere informati dei potenziali rischi e benefici di Janumet e delle modalità alternative di terapia. Dovrebbero anche essere informati dell'importanza dell'adesione alle istruzioni dietetiche, all'attività fisica regolare, al sangue periodico monitoraggio del glucosio e test A1C, riconoscimento e gestione dell'ipoglicemia e dell'iperglicemia e valutazione del diabete complicazioni. Durante periodi di stress come febbre, traumi, infezioni o interventi chirurgici, le esigenze terapeutiche possono cambiare e i pazienti devono essere avvisati di consultare prontamente un medico.
I rischi di acidosi lattica dovuta al componente metformina, ai suoi sintomi e alle condizioni che predispongono al suo sviluppo, come osservato in Avvertenze e precauzioni, dovrebbe essere spiegato ai pazienti. I pazienti devono essere avvisati di interrompere immediatamente Janumet e di informare prontamente il proprio medico in caso di iperventilazione inspiegabile, mialgia, malessere, sonnolenza insolita, vertigini, battito cardiaco lento o irregolare, sensazione di sensazione di freddo (specialmente alle estremità) o altri sintomi aspecifici si verificano. I sintomi gastrointestinali sono comuni all'inizio del trattamento con metformina e possono verificarsi durante l'inizio della terapia con Janumet; tuttavia, i pazienti devono consultare il proprio medico se sviluppano sintomi inspiegabili. Sebbene sia improbabile che i sintomi gastrointestinali che si verificano dopo la stabilizzazione siano correlati al farmaco, tale l'insorgenza di sintomi deve essere valutata per determinare se può essere dovuta a acidosi lattica o altri gravi malattia.
I pazienti devono essere informati sull'assunzione eccessiva di alcol, acuta o cronica, durante il trattamento con Janumet.
I pazienti devono essere informati dell'importanza di test regolari della funzionalità renale e dei parametri ematologici durante il trattamento con Janumet.
I pazienti devono essere informati che sono state riportate reazioni allergiche durante l'uso postmarketing di sitagliptin, uno dei componenti di Janumet. Se i sintomi di reazioni allergiche (inclusi rash cutaneo, orticaria e gonfiore di viso, labbra, lingua e gola che possono causa difficoltà respiratorie o deglutizione), i pazienti devono interrompere l'assunzione di Janumet e consultare un medico prontamente.
I medici devono istruire i loro pazienti a leggere il foglietto illustrativo del paziente prima di iniziare la terapia con Janumet e a rileggere ogni volta che la prescrizione viene rinnovata. I pazienti devono essere istruiti a informare il proprio medico o farmacista se sviluppano sintomi insoliti o se persiste o peggiora qualsiasi sintomo noto.
Test di laboratorio
La risposta a tutte le terapie diabetiche deve essere monitorata mediante misurazioni periodiche della glicemia e dei livelli di A1C, con l'obiettivo di ridurre questi livelli verso l'intervallo normale. L'A1C è particolarmente utile per la valutazione del controllo glicemico a lungo termine.
Monitoraggio iniziale e periodico dei parametri ematologici (ad es. Emoglobina / ematocrito e sangue rosso) indici cellulari) e la funzionalità renale (creatinina sierica) devono essere eseguite, almeno su base annuale. Mentre l'anemia megaloblastica è stata osservata raramente con la terapia con metformina, se questo è sospettato, la carenza di vitamina B12 dovrebbe essere esclusa.
Distribuito da:
MERCK & CO., INC., Whitehouse Station, NJ 08889, USA
9794108
Brevetto USA n. 6.699.871
1 Marchio registrato di MERCK & CO., Inc., Whitehouse Station, New Jersey 08889 USA
2 Marchio commerciale di MERCK & CO., Inc., Whitehouse Station, New Jersey 08889 USA
3GLUCOPHAGE® è un marchio registrato di Merck Sante S.A.S, una consociata di Merck KGaA di Darmstadt, Germania.
Concesso in licenza alla Bristol-Myers Squibb Company.
COPYRIGHT © 2007, 2008 MERCK & CO., Inc.
Tutti i diritti riservati
Etichettatura paziente approvata dalla FDA
Informazioni per il paziente
Janumet® (JAN-you-met)
(sitagliptin / metformin HCl)
compresse
Leggere le informazioni sul paziente fornite con Janumet1 prima di iniziare a prenderlo e ogni volta che si ottiene una ricarica. Potrebbero esserci nuove informazioni. Questo opuscolo non sostituisce il parlare con il medico delle sue condizioni mediche o del trattamento.
Quali sono le informazioni più importanti che dovrei sapere su Janumet?
La metformina cloridrato, uno degli ingredienti di Janumet, può causare un raro ma grave effetto collaterale chiamato acidosi lattica (un accumulo di acido lattico nel sangue) che può causare la morte. L'acidosi lattica è un'emergenza medica e deve essere trattata in ospedale.
Interrompere l'assunzione di Janumet e chiamare immediatamente il medico se si manifesta uno dei seguenti sintomi di acidosi lattica:
- Ti senti molto debole e stanco.
- Hai dolori muscolari insoliti (non normali).
- Hai difficoltà a respirare.
- Hai problemi di stomaco o intestinali inspiegabili con nausea e vomito o diarrea.
- Ti senti freddo, specialmente nelle braccia e nelle gambe.
- Hai vertigini o stordimento.
- Hai un battito cardiaco lento o irregolare.
Hai maggiori possibilità di contrarre l'acidosi lattica se:
- ha problemi ai reni
- ha problemi al fegato
- ha insufficienza cardiaca congestizia che richiede un trattamento con medicinali.
- bere molto alcool (molto spesso o "abbuffarsi" a breve termine).
- disidratarsi (perdere una grande quantità di liquidi corporei). Questo può accadere se sei malato di febbre, vomito o diarrea. La disidratazione può verificarsi anche quando si suda molto con l'attività o l'esercizio fisico e non si beve abbastanza liquidi.
- eseguire alcuni esami radiografici con coloranti iniettabili o agenti di contrasto.
- fare un intervento chirurgico.
- ha un attacco di cuore, un'infezione grave o un ictus.
- hanno 80 anni o più e non sono stati sottoposti a test di funzionalità renale.
Che cos'è Janumet?
Le compresse di Janumet contengono due medicinali soggetti a prescrizione medica, sitagliptin (JANUVIA ™ 2) e metformina. Janumet può essere usato insieme alla dieta e all'esercizio fisico per ridurre la glicemia nei pazienti adulti con diabete di tipo 2. Il medico stabilirà se Janumet è giusto per te e determinerà il modo migliore per iniziare e continuare a curare il diabete.
Janumet:
- aiuta a migliorare i livelli di insulina dopo un pasto.
- aiuta il corpo a rispondere meglio all'insulina che produce naturalmente.
- diminuisce la quantità di zucchero prodotta dall'organismo.
- è improbabile che causi un basso livello di zucchero nel sangue (ipoglicemia) quando viene assunto da solo per trattare la glicemia alta.
Janumet non è stato studiato nei bambini di età inferiore ai 18 anni.
Janumet non è stato studiato con insulina, un medicinale noto per causare bassi livelli di zucchero nel sangue.
Chi non dovrebbe prendere Janumet?
Non prenda Janumet se:
- ha il diabete di tipo 1
- ha alcuni problemi ai reni
- hanno condizioni chiamate acidosi metabolica o chetoacidosi diabetica (aumento dei chetoni nel sangue o nelle urine).
- ha avuto una reazione allergica a Janumet o sitagliptin (JANUVIA), uno dei componenti di Janumet.
- riceveranno un'iniezione di coloranti o agenti di contrasto per una procedura radiografica, Janumet dovrà essere interrotto per un breve periodo. Parlate con il vostro medico di quando interrompere Janumet e quando ricominciare. Vedi "Quali sono le informazioni più importanti che dovrei sapere su Janumet?"
Cosa devo dire al mio medico prima e durante il trattamento con Janumet?
Janumet potrebbe non essere adatto a te. Informa il tuo medico di tutte le tue condizioni mediche, incluso se:
- ha problemi ai reni
- ha problemi al fegato
- ha avuto una reazione allergica a Janumet o sitagliptin (JANUVIA), uno dei componenti di Janumet.
- ha problemi cardiaci, inclusa insufficienza cardiaca congestizia.
- hanno più di 80 anni. I pazienti di età superiore a 80 anni non devono assumere Janumet a meno che la loro funzionalità renale non sia controllata ed è normale.
- bere molto alcolici (bere continuamente o a lungo termine "binge").
- è incinta o sta pianificando una gravidanza. Non è noto se Janumet danneggerà il tuo bambino non ancora nato. Se sei incinta, parla con il tuo medico del modo migliore per controllare la glicemia durante la gravidanza. Se usi Janumet durante la gravidanza, parla con il tuo medico di come puoi essere nel registro di Janumet. Il numero telefonico gratuito per il registro delle gravidanze è 1-800-986-8999.
- sta allattando o sta pianificando di allattare. Non è noto se Janumet passi nel latte materno. Parlate con il vostro medico del modo migliore per nutrire il bambino se sta assumendo Janumet.
Informa il tuo medico di tutti i medicinali che assumi, inclusi medicinali su prescrizione e non soggetti a prescrizione, vitamine e integratori a base di erbe. Janumet può influire sul funzionamento di altri farmaci e alcuni farmaci possono influire sul funzionamento di Janumet.
Conosci le medicine che prendi. Tieni un elenco dei tuoi medicinali e mostralo al tuo medico e farmacista quando ricevi un nuovo medicinale. Si rivolga al medico prima di iniziare qualsiasi nuova medicina.
Come dovrei prendere Janumet?
- Il medico le dirà quante compresse di Janumet assumere e con quale frequenza deve assumerle. Prenda Janumet seguendo esattamente le istruzioni del medico.
- Il medico potrebbe dover aumentare la dose per controllare la glicemia.
- Il medico può prescrivere Janumet insieme a una sulfonilurea (un altro medicinale per ridurre la glicemia). Vedi "Quali sono i possibili effetti collaterali di Janumet?" per informazioni sull'aumento del rischio di ipoglicemia.
- Assumere Janumet ai pasti per ridurre le possibilità di mal di stomaco.
- Continui a prendere Janumet per tutto il tempo prescritto dal medico.
- Se prende troppo Janumet, chiama immediatamente il medico o il centro antiveleni.
- Se si dimentica una dose, prenderla con il cibo non appena se ne ricorda. Se non ricorda fino a quando non è il momento della dose successiva, salti la dose dimenticata e torni al normale programma. Non prendere due dosi di Janumet contemporaneamente.
- Potrebbe essere necessario interrompere l'assunzione di Janumet per un breve periodo. Chiama il tuo medico per istruzioni se:
- sono disidratati (hanno perso troppo fluido corporeo). La disidratazione può verificarsi in caso di vomito grave, diarrea o febbre o se si beve molto meno liquido del normale.
- piano di avere un intervento chirurgico.
- riceveranno un'iniezione di colorante o agente di contrasto per una procedura radiografica.
Vedi "Quali sono le informazioni più importanti che dovrei sapere su Janumet?" e "Chi non dovrebbe prendere Janumet?"
- Quando il tuo corpo è sottoposto ad alcuni tipi di stress, come febbre, traumi (come un incidente d'auto), infezione o chirurgia, la quantità di medicinali per il diabete di cui hai bisogno può cambiare. Informi immediatamente il medico se si dispone di una di queste condizioni e seguire le istruzioni del medico.
- Controlla il livello di zucchero nel sangue come prescritto dal medico.
- Mantieni la dieta e il programma di allenamento prescritti mentre prendi Janumet.
- Parlate con il vostro medico su come prevenire, riconoscere e gestire la glicemia bassa (ipoglicemia), la glicemia alta (iperglicemia) e le complicanze del diabete.
- Il medico monitorerà il diabete con esami del sangue regolari, compresi i livelli di zucchero nel sangue e l'emoglobina A1C.
- Il medico eseguirà esami del sangue per verificare la funzionalità renale prima e durante il trattamento con Janumet.
Quali sono i possibili effetti collaterali di Janumet?
Janumet può causare gravi effetti collaterali. Vedi "Quali sono le informazioni più importanti che dovrei sapere su Janumet?"
Effetti indesiderati comuni durante l'assunzione di Janumet includono:
- naso chiuso o che cola e mal di gola
- infezione delle vie respiratorie superiori
- diarrea
- nausea e vomito
- gas, fastidio allo stomaco, indigestione
- debolezza
- mal di testa
L'assunzione di Janumet con i pasti può aiutare a ridurre gli effetti collaterali della metformina che si verificano di solito all'inizio del trattamento. In caso di problemi di stomaco insoliti o imprevisti, consultare il medico. I problemi di stomaco che si manifestano più tardi durante il trattamento possono essere un segno di qualcosa di più serio.
Alcuni medicinali per il diabete, come le sulfoniluree e i meglitinidi, possono causare ipoglicemia (ipoglicemia). Quando Janumet viene usato con questi medicinali, è possibile che gli zuccheri nel sangue siano troppo bassi. Il medico può prescrivere dosi più basse di sulfonilurea o di meglitinide. Informi il medico se si hanno problemi con bassi livelli di zucchero nel sangue.
I seguenti effetti indesiderati aggiuntivi sono stati riportati in uso generale con Janumet o sitagliptin:
- Reazioni allergiche gravi possono verificarsi con Janumet o sitagliptin, uno dei medicinali di Janumet. I sintomi di una grave reazione allergica possono includere eruzione cutanea, orticaria e gonfiore di viso, labbra, lingua e gola, difficoltà respiratorie o deglutizione. In caso di reazione allergica, interrompere l'assunzione di Janumet e chiamare immediatamente il medico. Il medico può prescrivere un farmaco per trattare la tua reazione allergica e un altro farmaco per il diabete.
- Enzimi epatici elevati.
- Infiammazione del pancreas.
Questi non sono tutti i possibili effetti collaterali di Janumet. Per ulteriori informazioni, consultare il medico.
Informi il medico se ha qualche effetto collaterale che ti disturba, è insolito o non scompare.
Come devo conservare Janumet?
Conservare Janumet a temperatura ambiente, 20-25 ° C (68-77 ° F).
Tenere Janumet e tutti i medicinali fuori dalla portata dei bambini.
Informazioni generali sull'uso di Janumet
Talvolta vengono prescritti medicinali per condizioni che non sono menzionate nei fogli illustrativi per i pazienti. Non usare Janumet per una condizione per la quale non è stato prescritto. Non dare Janumet ad altre persone, anche se hanno gli stessi sintomi che hai. Potrebbe danneggiarli.
Questo opuscolo riassume le informazioni più importanti su Janumet. Se desideri avere maggiori informazioni, parla con il tuo medico. Puoi chiedere al tuo medico o farmacista informazioni su Janumet scritte per gli operatori sanitari. Per ulteriori informazioni, chiamare il numero 1-800-622-4477.
Quali sono gli ingredienti in Janumet?
Principi attivi: sitagliptin e metformina cloridrato.
Ingredienti inattivi: cellulosa microcristallina, polivinilpirrolidone, sodio lauril solfato e sodio stearil fumarato. Il rivestimento del film della compressa contiene i seguenti ingredienti inattivi: alcool polivinilico, polietilenglicole, talco, biossido di titanio, ossido di ferro rosso e ossido di ferro nero.
Cos'è il diabete di tipo 2?
Il diabete di tipo 2 è una condizione in cui il corpo non produce abbastanza insulina e l'insulina prodotta dall'organismo non funziona come dovrebbe. Il tuo corpo può anche produrre troppo zucchero. Quando ciò accade, lo zucchero (glucosio) si accumula nel sangue. Ciò può portare a gravi problemi di salute.
L'obiettivo principale del trattamento del diabete è di abbassare la glicemia a un livello normale. Abbassare e controllare la glicemia può aiutare a prevenire o ritardare le complicanze del diabete, come problemi cardiaci, problemi renali, cecità e amputazione.
La glicemia alta può essere abbassata dalla dieta e dall'esercizio fisico e da determinati medicinali quando necessario.
Rilasciato marzo 2009
Distribuito da:
MERCK & CO., INC., Whitehouse Station, NJ 08889, USA
Ultimo aggiornamento: 03/09
Janumet, Sitagliptin e Metformin Hydrochloride, Informazioni paziente (in inglese semplice)
Informazioni dettagliate su segni, sintomi, cause, trattamenti del diabete
Le informazioni contenute in questa monografia non intendono coprire tutti i possibili usi, indicazioni, precauzioni, interazioni farmacologiche o effetti avversi. Questa informazione è generalizzata e non è intesa come consulenza medica specifica. Se ha domande sui medicinali che sta assumendo o desidera maggiori informazioni, consultare il medico, il farmacista o l'infermiere.
torna a: Sfoglia tutti i farmaci per il diabete


