Glucophage per il trattamento del diabete
Marchio: Glucophage
Nome generico: metformina cloridrato
Forma di dosaggio: compresse a rilascio prolungato
Contenuti:
Descrizione
Farmacologia clinica
Indicazioni e utilizzo
Controindicazioni
Avvertenze
Precauzioni
Interazioni farmacologiche
Reazioni avverse
Overdose
Dosaggio
Fornito
Glucohage, metformina cloridrato, informazioni per il paziente (in inglese semplice)
Descrizione
Compresse Glucophage® (metformina cloridrato) e Glucophage® XR (metformina cloridrato) Le compresse a rilascio prolungato sono farmaci antiiperglicemici orali utilizzati nella gestione del diabete di tipo 2. La metformina cloridrato (N, N-dimetilimidodicarbonimidico diamide cloridrato) non è chimicamente o farmacologicamente correlata ad altre classi di agenti antiiperglicemici orali. La formula strutturale è come mostrato:
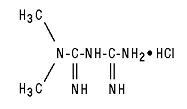
La metformina cloridrato è un composto cristallino da bianco a biancastro con una formula molecolare di C4H11N5 - HCl e un peso molecolare di 165,63. La metformina cloridrato è liberamente solubile in acqua ed è praticamente insolubile in acetone, etere e cloroformio. Il pKa di metformina è 12,4. Il pH di una soluzione acquosa all'1% di metformina cloridrato è 6,68.
Le compresse di glucofago contengono 500 mg, 850 mg o 1000 mg di metformina cloridrato. Ogni compressa contiene gli ingredienti inattivi povidone e magnesio stearato. Inoltre, il rivestimento per le compresse da 500 mg e 850 mg contiene ipromellosa e il rivestimento per le compresse da 1000 mg contiene ipromellosa e polietilenglicole.
Glucophage XR contiene 500 mg o 750 mg di metformina cloridrato come ingrediente attivo.
Le compresse di Glucophage XR 500 mg contengono gli ingredienti inattivi carbossimetilcellulosa di sodio, ipromellosa, cellulosa microcristallina e magnesio stearato.
Le compresse di Glucophage XR 750 mg contengono gli ingredienti inattivi carbossimetilcellulosa di sodio, ipromellosa e magnesio stearato.
Componenti del sistema e Performance-Glucophage XR comprende un doppio sistema di matrice polimerica idrofila. La metformina cloridrato è combinata con un polimero di controllo del rilascio di farmaco per formare una fase "interna", che viene quindi incorporata come particelle discrete in una fase "esterna" di un secondo polimero. Dopo la somministrazione, il fluido dal tratto gastrointestinale (GI) entra nella compressa, facendo idratare e gonfiare i polimeri. La medicina viene rilasciata lentamente dalla forma di dosaggio mediante un processo di diffusione attraverso la matrice di gel che è essenzialmente indipendente dal pH. Il sistema polimerico idratato non è rigido e si prevede che venga rotto dalla normale peristalsi nel tratto gastrointestinale. I componenti biologicamente inerti della compressa possono occasionalmente rimanere intatti durante il transito gastrointestinale e saranno eliminati nelle feci come una massa morbida e idratata.
superiore
Farmacologia clinica
Meccanismo di azione
La metformina è un agente antiiperglicemico che migliora la tolleranza al glucosio nei pazienti con diabete di tipo 2, riducendo il glucosio plasmatico basale e postprandiale. I suoi meccanismi di azione farmacologica sono diversi dalle altre classi di agenti antiiperglicemici orali. La metformina riduce la produzione di glucosio epatico, diminuisce l'assorbimento intestinale di glucosio e migliora la sensibilità all'insulina aumentando l'assorbimento e l'utilizzo periferici del glucosio. A differenza delle sulfoniluree, la metformina non produce ipoglicemia in entrambi i pazienti con diabete di tipo 2 o in soggetti normali (tranne in circostanze speciali, vedere PRECAUZIONI) e non causa iperinsulinemia. Con la terapia con metformina, la secrezione di insulina rimane invariata mentre i livelli di insulina a digiuno e la risposta plasmatica di insulina durante il giorno possono effettivamente diminuire.
farmacocinetica
Assorbimento e biodisponibilità
La biodisponibilità assoluta di una compressa di Glucophage da 500 mg somministrata a digiuno è compresa tra circa il 50% e il 60%. Gli studi condotti con dosi orali singole di Glucophage da 500 a 1500 mg e da 850 a 2550 mg indicano che manca proporzionalità della dose all'aumentare della dose, dovuta a un ridotto assorbimento piuttosto che a un'alterazione eliminazione. Il cibo diminuisce l'estensione e ritarda leggermente l'assorbimento della metformina, come mostrato da un picco medio di picco inferiore di circa il 40% concentrazione (Cmax), un'area inferiore del 25% sotto la concentrazione plasmatica rispetto alla curva del tempo (AUC) e un prolungamento di 35 minuti del tempo al picco concentrazione plasmatica (Tmax) in seguito alla somministrazione di una singola compressa da 850 mg di metformina con il cibo, rispetto allo stesso dosaggio della compressa digiuno amministrato. La rilevanza clinica di queste diminuzioni non è nota.
Dopo una singola dose orale di Glucophage XR, la Cmax viene raggiunta con un valore mediano di 7 ore e un intervallo da 4 a 8 ore. I livelli plasmatici di picco sono inferiori di circa il 20% rispetto alla stessa dose di Glucophage, tuttavia, l'estensione dell'assorbimento (misurata dall'AUC) è simile al Glucophage.
Allo stato stazionario, l'AUC e la Cmax sono meno che proporzionali alla dose per Glucophage XR nell'intervallo da 500 a 2000 mg somministrati una volta al giorno. I livelli plasmatici di picco sono circa 0,6, 1,1, 1,4 e 1,8 µg / mL per dosi giornaliere di 500, 1000, 1500 e 2000 mg, rispettivamente. L'entità dell'assorbimento della metformina (misurata dall'AUC) da Glucophage XR alla dose di 2000 mg una volta al giorno è simile alla stessa dose giornaliera totale somministrata come compresse di Glucophage 1000 mg due volte al giorno. Dopo ripetute somministrazioni di Glucophage XR, la metformina non si è accumulata nel plasma.
La variabilità all'interno del soggetto nella Cmax e nell'AUC della metformina da Glucophage XR è paragonabile a quella con Glucophage.
Sebbene l'estensione dell'assorbimento della metformina (misurata dall'AUC) dalla compressa di Glucophage XR aumentato di circa il 50% quando somministrato con il cibo, non vi è stato alcun effetto del cibo su Cmax e Tmax di metformina. Sia i pasti ricchi di grassi che quelli bassi hanno avuto lo stesso effetto sulla farmacocinetica di Glucophage XR.
Distribuzione
Il volume apparente di distribuzione (V / F) della metformina dopo singole dosi orali di Glucophage 850 mg era in media 654 ± 358 L. La metformina è legata in modo trascurabile alle proteine plasmatiche, a differenza delle sulfoniluree, che sono legate per oltre il 90% alle proteine. La metformina si divide in eritrociti, molto probabilmente in funzione del tempo. Alle normali dosi cliniche e ai programmi di dosaggio di Glucophage, le concentrazioni plasmatiche di metformina allo stato stazionario vengono raggiunte entro 24-48 ore e sono generalmente
Metabolismo ed eliminazione
Gli studi per dose singola endovenosa in soggetti normali dimostrano che la metformina viene escreta immodificata nel urina e non subisce metabolismo epatico (nessun metabolita è stato identificato nell'uomo) né biliare escrezione. Autorizzazione renale (vedere Tabella 1) è circa 3,5 volte maggiore della clearance della creatinina, il che indica che la secrezione tubulare è la principale via di eliminazione della metformina. Dopo somministrazione orale, circa il 90% del farmaco assorbito viene eliminato per via renale entro le prime 24 ore, con un'emivita di eliminazione plasmatica di circa 6,2 ore. Nel sangue, l'emivita di eliminazione è di circa 17,6 ore, suggerendo che la massa eritrocitaria può essere un compartimento di distribuzione.
Popolazioni speciali
Pazienti con diabete di tipo 2
In presenza di una normale funzionalità renale, non vi sono differenze tra la farmacocinetica a dose singola o multipla di metformina tra pazienti con diabete di tipo 2 e soggetti normali (vedere Tabella 1), né vi è alcun accumulo di metformina in entrambi i gruppi alle normali dosi cliniche.
La farmacocinetica di Glucophage XR nei pazienti con diabete di tipo 2 è paragonabile a quella degli adulti normali sani.
Insufficienza renale
Nei pazienti con ridotta funzionalità renale (basata sulla clearance della creatinina misurata), l'emivita plasmatica e ematica di la metformina è prolungata e la clearance renale è ridotta in proporzione alla diminuzione della clearance della creatinina (vedere Tabella 1; vedi anche AVVERTENZE).
Insufficienza epatica
Non sono stati condotti studi di farmacocinetica sulla metformina in pazienti con insufficienza epatica.
Geriatria
Dati limitati provenienti da studi farmacocinetici controllati sul glucofago in soggetti anziani sani suggeriscono che il plasma totale la clearance della metformina è ridotta, l'emivita è prolungata e la Cmax è aumentata rispetto ai giovani sani soggetti. Da questi dati, sembra che il cambiamento nella farmacocinetica della metformina con l'invecchiamento sia principalmente dovuto a un cambiamento della funzionalità renale (vedere Tabella 1). Il trattamento con compresse di glucosio (metformina cloridrato) e Glucophage XR (metformina cloridrato) non deve essere iniziato in pazienti di età â 80 anni a meno che la misurazione della clearance della creatinina non dimostri che la funzionalità renale non è ridotta (vedere AVVERTENZE e DOSAGGIO E SOMMINISTRAZIONE).
Tabella 1: Selezionare i parametri farmacocinetici medi (± S.D.) Della metformina dopo dosi orali singole o multiple di glucofago
| Gruppi di soggetti: dose di glucofagoun' (numero di soggetti) |
CmaxB (µg / mL) |
Tmaxc (ore) |
Liquidazione renale (Ml / min) |
|---|---|---|---|
| un' Tutte le dosi somministrate a digiuno tranne le prime 18 dosi degli studi a dose multipla | |||
| B Picco di concentrazione plasmatica | |||
| c Tempo per raggiungere il picco della concentrazione plasmatica | |||
| d Risultati combinati (media media) di cinque studi: età media 32 anni (intervallo 23-59 anni) | |||
| e Studio cinetico condotto dopo la dose 19, a digiuno | |||
| f Soggetti anziani, età media 71 anni (range 65-81 anni) | |||
| g CLcr = clearance della creatinina normalizzata alla superficie corporea di 1,73 m2 | |||
| Adulti sani e non diabetici: | |||
| 500 mg dose singola (24) | 1.03 ( ±0.33) | 2.75 ( ±0.81) | 600 ( ±132) |
| 850 mg dose singola (74)d | 1.60 ( ±0.38) | 2.64 ( ±0.82) | 552 ( ±139) |
| 850 mg tre volte al giorno per 19 dosie (9) | 2.01 ( ±0.42) | 1.79 ( ±0.94) | 642 ( ±173) |
| Adulti con diabete di tipo 2: | |||
| 850 mg dose singola (23) | 1.48 ( ±0.5) | 3.32 ( ±1.08) | 491 ( ±138) |
| 850 mg tre volte al giorno per 19 dosie (9) | 1.90 ( ±0.62) | 2.01 ( ±1.22) | 550 ( ±160) |
| anzianof, adulti non diabetici sani: | |||
| 850 mg dose singola (12) | 2.45 ( ±0.70) | 2.71 ( ±1.05) | 412 ( ±98) |
| Adulti con insufficienza renale: | |||
| 850 mg monodose | |||
| Lieve (CLcrg 61-90 mL / min) (5) | 1.86 ( ±0.52) | 3.20 ( ±0.45) | 384 ( ±122) |
| Moderato (CLcr 31-60 mL / min) (4) | 4.12 ( ±1.83) | 3.75 ( ±0.50) | 108 ( ±57) |
| Grave (CLcr 10-30 mL / min) (6) | 3.93 ( ±0.92) | 4.01 ( ±1.10) | 130 ( ±90 |
Pediatria
Dopo la somministrazione di una singola compressa orale di glucosio da 500 mg con il cibo, la metformina media geometrica Cmax e AUC differivano meno del 5% tra pazienti diabetici di tipo 2 pediatrici (12-16 anni di età) e adulti sani di pari peso e sesso (20-45 anni di età), tutti con rene normale funzione
Genere
I parametri farmacocinetici della metformina non differivano significativamente tra soggetti normali e pazienti con diabete di tipo 2 quando analizzati in base al sesso (maschi = 19, femmine = 16). Allo stesso modo, negli studi clinici controllati su pazienti con diabete di tipo 2, l'effetto anti-iperglicemico del glucofago era comparabile nei maschi e nelle femmine.
Gara
Non sono stati condotti studi sui parametri farmacocinetici della metformina in base alla razza. In studi clinici controllati sul glucofago in pazienti con diabete di tipo 2, l'effetto anti-iperglicemico è stato comparabile nei bianchi (n = 249), nei neri (n = 51) e negli ispanici (n = 24).
Studi clinici
Glucophage
In uno studio clinico statunitense multicentrico in doppio cieco, controllato con placebo, che ha coinvolto pazienti obesi con diabete di tipo 2 la cui iperglicemia non era adeguatamente controllata con la sola gestione dietetica (glicemia a digiuno al basale [FPG] di circa 240 mg / dL), il trattamento con Glucophage (fino a 2550 mg / die) per 29 settimane ha determinato significativi riduzioni nette medie della glicemia a digiuno e postprandiale (PPG) e dell'emoglobina A1c (HbA1c) rispettivamente di 59 mg / dL, 83 mg / dL e 1,8%, rispetto al gruppo placebo (vedere Tavolo 2).
Tabella 2: Glucophage vs Placebo Sommario delle variazioni medie rispetto al basale * nel glucosio al plasma a digiuno, HbA1ce peso corporeo alla visita finale (studio di 29 settimane)
| Glucophage (N = 141) |
Placebo (N = 145) |
p-Valore | |
|---|---|---|---|
| * Tutti i pazienti in terapia dietetica al basale | ** Non statisticamente significativo | ||
| FPG (mg / dL) Baseline Modifica a FINAL VISIT |
241.5 -53.0 |
237.7 6.3 |
NS ** 0.001 |
| Emoglobina A1c (%) Baseline Modifica a FINAL VISIT |
8.4 -1.4 |
8.2 0.4 |
NS ** 0.001 |
| Peso corporeo (libbre) Baseline Modifica a FINAL VISIT |
201.0 -1.4 |
206.0 -2.4 |
NS ** NS ** |
È stato condotto uno studio di 29 settimane, in doppio cieco, controllato con placebo su glucofago e gliburide, da solo e in associazione, in pazienti obesi con tipo 2 diabete che non era riuscito a raggiungere un adeguato controllo glicemico durante le dosi massime di gliburide (FPG basale di circa 250 mg / dL) (vedere Tabella 3). I pazienti randomizzati al braccio combinato hanno iniziato la terapia con Glucophage 500 mg e glyburide 20 mg. Alla fine di ogni settimana delle prime 4 settimane di sperimentazione, questi pazienti avevano aumentato i loro dosaggi di glucofago di 500 mg se non erano riusciti a raggiungere la glicemia a digiuno target. Dopo la settimana 4, tali aggiustamenti del dosaggio sono stati effettuati mensilmente, sebbene a nessun paziente sia stato permesso di superare i 2500 mg di glucofago. I pazienti nel solo braccio del glucofago (metformina più placebo) hanno seguito lo stesso programma di titolazione. Alla fine dello studio, circa il 70% dei pazienti nel gruppo di associazione stava assumendo Glucophage 2000 mg / glyburide 20 mg o Glucophage 2500 mg / glyburide 20 mg. I pazienti randomizzati a continuare con glyburide hanno manifestato un peggioramento del controllo glicemico, con aumenti medi di FPG, PPG e HbA1c rispettivamente di 14 mg / dL, 3 mg / dL e 0,2%. Al contrario, quelli randomizzati a Glucophage (fino a 2500 mg / die) hanno mostrato un leggero miglioramento, con riduzioni medie di FPG, PPG e HbA1c rispettivamente di 1 mg / dL, 6 mg / dL e 0,4%. La combinazione di Glucophage e glyburide è risultata efficace nel ridurre i livelli di FPG, PPG e HbA1c rispettivamente di 63 mg / dL, 65 mg / dL e 1,7%. Rispetto ai risultati del solo trattamento con gliburide, le differenze nette con il trattamento combinato sono state rispettivamente di -77 mg / dL, -68 mg / dL e -1,9% (vedere Tabella 3).
Tabella 3: Monoterapia con Glucophage / Glyburide (Comb) combinata vs Glyburide (Glyb) o Glucophage (GLU): Riepilogo delle variazioni medie rispetto al basale * in Glucosio al plasma a digiuno, HbA1ce peso corporeo alla visita finale (studio di 29 settimane)
| valori p | ||||||
|---|---|---|---|---|---|---|
| Pettine (N = 213) |
Glyb (N = 209) |
GLU (N = 210) |
Glyb vs Pettine |
GLU vs Pettine |
GLU vs Glyb |
|
| * Tutti i pazienti trattati con glyburide, 20 mg / die, al basale | ** Non statisticamente significativo | |||||
| Glucosio al plasma a digiuno (mg / dL) | ||||||
| Baseline Modifica a FINAL VISIT |
250.5 -63.5 |
247.5 13.7 |
253.9 -0.9 |
NS ** 0.001 |
NS ** 0.001 |
NS ** 0.025 |
| Emoglobina A1c (%) | ||||||
| Baseline Modifica a FINAL VISIT |
8.8 -1.7 |
8.5 0.2 |
8.9 -0.4 |
NS ** 0.001 |
NS ** 0.001 |
0.007 0.001 |
| Peso corporeo (libbre) | ||||||
| Baseline Modifica a FINAL VISIT |
202.2 0.9 |
203.0 -0.7 |
204.0 -8.4 |
NS ** 0.011 |
NS ** 0.001 |
NS ** 0.001 |
L'entità del calo della concentrazione di glucosio nel sangue a digiuno a seguito dell'istituzione di Glucophage (metformin hydrochloride) La terapia con compresse era proporzionale al livello di digiuno iperglicemia. I pazienti con diabete di tipo 2 con concentrazioni di glucosio a digiuno più elevate hanno sperimentato un calo maggiore della glicemia e dell'emoglobina glicosilata.
Negli studi clinici, il glucofago, da solo o in combinazione con una sulfonilurea, ha ridotto il siero a digiuno medio trigliceridi, colesterolo totale e livelli di colesterolo LDL e non hanno avuto effetti avversi su altri livelli lipidici (vedere Tabella 4).
Tabella 4: Riepilogo della variazione percentuale media dal basale delle principali variabili lipidiche sieriche alla visita finale (studi di 29 settimane)
| Glucophage vs Placebo | Glucophage / Glyburide combinati vs monoterapia |
||||
|---|---|---|---|---|---|
| Glucophage (N = 141) |
Placebo (N = 145) |
Glucophage (N = 210) |
Glucophage / Glyburide (N = 213) |
Glyburide (N = 209) |
|
| Colesterolo totale (mg / dL) | |||||
| Baseline Variazione% media alla VISITA FINALE |
211.0 -5% |
212.3 1% |
213.1 -2% |
215.6 -4% |
219.6 1% |
| Trigliceridi totali (mg / dL) | |||||
| Baseline Variazione% media alla VISITA FINALE |
236.1 -16% |
203.5 1% |
242.5 -3% |
215.0 -8% |
266.1 4% |
| Colesterolo LDL (mg / dL) | |||||
| Baseline Variazione% media alla VISITA FINALE |
135.4 -8% |
138.5 1% |
134.3 -4% |
136.0 -6% |
137.5 3% |
| Colesterolo HDL (mg / dL) | |||||
| Baseline Variazione% media alla VISITA FINALE |
39.0 2% |
40.5 -1% |
37.2 5% |
39.0 3% |
37.0 1% |
Contrariamente alle sulfoniluree, il peso corporeo degli individui su Glucophage tendeva a rimanere stabile o addirittura a diminuire in qualche modo (vedi Tabelle 2 e 3).
Uno studio di 24 settimane, in doppio cieco, controllato con placebo su Glucophage più insulina contro insulina più placebo è stato condotto in pazienti con diabete di tipo 2 che non sono riusciti a raggiungere un adeguato controllo glicemico sulla sola insulina (vedere Tabella 5). I pazienti randomizzati a ricevere Glucophage più insulina hanno ottenuto una riduzione dell'HbA1c del 2,10%, rispetto a una riduzione dell'1,56% dell'HbA1c ottenuta con insulina più placebo. Il miglioramento del controllo glicemico è stato ottenuto durante la visita di studio finale con il 16% in meno di insulina, 93,0 U / giorno contro 110,6 U / giorno, Glucophage più insulina contro insulina più placebo, rispettivamente, p = 0,04.
Tabella 5: Riepilogo combinato glucosio / insulina vs placebo / insulina delle variazioni medie rispetto al basale in HbA1c e dose giornaliera di insulina
| Glucophage / Insulina (N = 26) |
Placebo/ Insulina (N = 28) |
Trattamento Differenza Media ± SE |
|
|---|---|---|---|
|
un' Statisticamente significativo usando l'analisi della covarianza con il basale come covariata (p = 0,04) Non significativo usando l'analisi della varianza (valori mostrati nella tabella) | |||
| B Statisticamente significativo per l'insulina (p = 0,04) | |||
| Emoglobina A1c (%) | |||
| Baseline Modifica a FINAL VISIT |
8.95 -2.10 |
9.32 -1.56 |
-0.54 ± 0.43un' |
| Dose di insulina (U / giorno) | |||
| Baseline Modifica a FINAL VISIT |
93.12 -0.15 |
94.64 15.93 |
-16.08 ± 7.77B |
Un secondo studio in doppio cieco, controllato con placebo (n = 51), con 16 settimane di trattamento randomizzato, ha dimostrato che in pazienti con diabete di tipo 2 controllato con insulina per 8 settimane con un HbA1c medio di 7,46 ± 0,97%, l'aggiunta di Glucophage ha mantenuto un controllo glicemico simile (HbA1c 7,15 ± 0,61 vs 6,97 ± 0,62 per Glucophage più insulina e placebo plus insulina, rispettivamente) con il 19% in meno di insulina rispetto al basale (riduzione di 23,68 ± 30,22 rispetto a un aumento di 0,43 ± 25,20 unità per Glucophage più insulina e placebo più insulina, p <0.01). Inoltre, questo studio ha dimostrato che la combinazione di glucofago e insulina ha portato a una riduzione nel peso corporeo di 3,11 ± 4,30 libbre, rispetto a un aumento di 1,30 ± 6,08 libbre per placebo più insulina, p = 0,01.
Glucophage XR
È stato condotto uno studio di Glucophage XR di 24 settimane, in doppio cieco, controllato con placebo, condotto una volta al giorno con il pasto serale pazienti con diabete di tipo 2 che non avevano raggiunto il controllo glicemico con dieta ed esercizio fisico (HbA1c 7,0% -10,0%, FPG 126-270 mg / dL). I pazienti che hanno iniziato lo studio avevano un HbA1c basale medio dell'8,0% e un FPG basale medio di 176 mg / dL. Dopo 12 settimane di trattamento, l'HbA1c medio era aumentato dal basale dello 0,1% e l'FPG medio era diminuito dal basale di 2 mg / dL nel gruppo placebo, confrontato con una diminuzione dell'HbA1c medio dello 0,6% e una diminuzione dell'FPG medio di 23 mg / dL nei pazienti trattati con Glucophage XR 1000 mg una volta quotidiano. Successivamente, la dose di trattamento è stata aumentata a 1500 mg una volta al giorno se l'HbA1c era del 7,0% ma <8,0% (i pazienti con HbA1c - 8,0% sono stati interrotti dallo studio). Alla visita finale (24 settimane), l'HbA1c medio era aumentato dello 0,2% rispetto al basale nei pazienti con placebo e diminuito dello 0,6% con Glucophage XR.
Uno studio di 16 settimane, in doppio cieco, controllato con placebo, dose-risposta di Glucophage XR, assunto una volta al giorno a cena o due volte al giorno ai pasti, è stato condotto in pazienti con diabete di tipo 2 che non avevano raggiunto il controllo glicemico con dieta ed esercizio fisico (HbA1c 7,0% -11,0%, FPG 126-280 mg / dL). I cambiamenti nel controllo glicemico e nel peso corporeo sono mostrati nella Tabella 6.
Tabella 6: Riepilogo delle variazioni medie rispetto al basale * in HbA1c, Glicemia a digiuno al plasma e peso corporeo alla visita finale (studio di 16 settimane)
| Glucophage XR | Placebo | |||||
|---|---|---|---|---|---|---|
| 500 mg Una volta Quotidiano |
1000 mg Una volta Quotidiano |
1500 mg Una volta Quotidiano |
2000 mg Una volta Quotidiano |
1000 mg Due volte Quotidiano |
||
| * Tutti i pazienti in terapia dietetica al basale | ||||||
| un' Tutti i confronti rispetto a Placebo | ||||||
| ** Non statisticamente significativo | ||||||
| Emoglobina A1c (%) | (N = 115) | (N = 115) | (N = 111) | (N = 125) | (N = 112) | (N = 111) |
| Baseline | 8.2 | 8.4 | 8.3 | 8.4 | 8.4 | 8.4 |
| Modifica a FINAL VISIT | -0.4 | -0.6 | -0.9 | -0.8 | -1.1 | 0.1 |
| p-valueun' | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 | - |
| FPG (mg / dL) | (N = 126) | (N = 118) | (N = 120) | (N = 132) | (N = 122) | (N = 113) |
| Baseline | 182.7 | 183.7 | 178.9 | 181.0 | 181.6 | 179.6 |
| Modifica a FINAL VISIT | -15.2 | -19.3 | -28.5 | -29.9 | -33.6 | 7.6 |
| p-valueun' | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 | - |
| Peso corporeo (libbre) | (N = 125) | (N = 119) | (N = 117) | (N = 131) | (N = 119) | (N = 113) |
| Baseline | 192.9 | 191.8 | 188.3 | 195.4 | 192.5 | 194.3 |
| Modifica a FINAL VISIT | -1.3 | -1.3 | -0.7 | -1.5 | -2.2 | -1.8 |
| p-valueun' | NS ** | NS ** | NS ** | NS ** | NS ** | - |
Rispetto al placebo, è stato osservato un miglioramento del controllo glicemico a tutti i livelli di dose di Glucophage XR (metformina cloridrato) Le compresse a rilascio prolungato e il trattamento non sono stati associati ad alcun cambiamento significativo di peso (vedere DOSAGGIO E SOMMINISTRAZIONE per le raccomandazioni sul dosaggio di Glucophage e Glucophage XR).
Uno studio randomizzato in doppio cieco di 24 settimane di Glucophage XR, assunto una volta al giorno con il pasto serale e compresse di Glucophage (metformina cloridrato), assunto due volte al giorno (con colazione e cena), è stato condotto in pazienti con diabete di tipo 2 che erano stati trattati con Glucophage 500 mg due volte al giorno per almeno 8 settimane prima dell'ingresso nello studio. La dose di glucofago non era stata necessariamente titolata per raggiungere un livello specifico di controllo glicemico prima dell'ingresso nello studio. I pazienti si sono qualificati per lo studio se HbA1c era... 8,5% e FPG era - 200 mg / dL. I cambiamenti nel controllo glicemico e nel peso corporeo sono mostrati nella Tabella 7.
Tabella 7: Riepilogo delle variazioni medie rispetto al basale * in HbA1c, Glicemia a digiuno al plasma e peso corporeo alla settimana 12 e alla visita finale (studio di 24 settimane)
| Glucophage 500 mg Due volte al giorno |
Glucophage XR | ||
|---|---|---|---|
| 1000 mg Una volta al giorno |
1500 mg Una volta al giorno |
||
| * Tutti i pazienti trattati con Glucophage 500 mg due volte al giorno al basale | |||
| un' n = 68 | |||
| Emoglobina A1c (%) | (N = 67) | (N = 72) | (N = 66) |
| Baseline | 7.06 | 6.99 | 7.02 |
| Cambio a 12 settimane | 0.14 | 0.23 | 0.04 |
| (IC al 95%) | (-0.03, 0.31) | (0.10, 0.36) | (-0.08, 0.15) |
| Modifica a FINAL VISIT | 0.14un' | 0.27 | 0.13 |
| (IC al 95%) | (-0.04, 0.31) | (0.11, 0.43) | (-0.02, 0.28) |
| FPG (mg / dL) | (N = 69) | (N = 72) | (N = 70) |
| Baseline | 127.2 | 131.0 | 131.4 |
| Cambio a 12 settimane | 12.9 | 9.5 | 3.7 |
| (IC al 95%) | (6.5, 19.4) | (4.4, 14.6) | (-0.4, 7.8) |
| Modifica a FINAL VISIT | 14.0 | 11.5 | 7.6 |
| (IC al 95%) | (7.0, 21.0) | (4.4, 18.6) | (1.0, 14.2) |
| Peso corporeo (libbre) | (N = 71) | (N = 74) | (N = 71) |
| Baseline | 210.3 | 202.8 | 192.7 |
| Cambio a 12 settimane | 0.4 | 0.9 | 0.7 |
| (IC al 95%) | (-0.4, 1.5) | (0.0, 2.0) | (-0.4, 1.8) |
| Modifica a FINAL VISIT | 0.9 | 1.1 | 0.9 |
| (IC al 95%) | (-0.4, 2.2) | (-0.2, 2.4) | (-0.4, 2.0) |
Dopo 12 settimane di trattamento, si è verificato un aumento dell'HbA medio1c in tutti i gruppi; nel gruppo Glucophage XR 1000 mg, l'aumento dal basale dello 0,23% era statisticamente significativo (vedere DOSAGGIO E SOMMINISTRAZIONE).
Le variazioni dei parametri lipidici nello studio dose-risposta di Glucophage XR precedentemente descritto, sono mostrati nella Tabella 8.
Tabella 8: Riepilogo delle variazioni percentuali medie dal basale * nelle principali variabili lipidiche alla visita finale (studio di 16 settimane)
| Glucophage XR | Placebo | |||||
|---|---|---|---|---|---|---|
| 500 mg Una volta Quotidiano |
1000 mg Una volta Quotidiano |
1500 mg Una volta Quotidiano |
2000 mg Una volta Quotidiano |
1000 mg Due volte Quotidiano |
||
| * Tutti i pazienti in terapia dietetica al basale | ||||||
| Colesterolo totale (mg / dL) | (N = 120) | (N = 113) | (N = 110) | (N = 126) | (N = 117) | (N = 110) |
| Baseline | 210.3 | 218.1 | 214.6 | 204.4 | 208.2 | 208.6 |
| Variazione% media alla VISITA FINALE | 1.0% | 1.7% | 0.7% | -1.6% | -2.6% | 2.6% |
| Trigliceridi totali (mg / dL) | (N = 120) | (N = 113) | (N = 110) | (N = 126) | (N = 117) | (N = 110) |
| Baseline | 220.2 | 211.9 | 198.0 | 194.2 | 179.0 | 211.7 |
| Variazione% media alla VISITA FINALE | 14.5% | 9.4% | 15.1% | 14.9% | 9.4% | 10.9% |
| Colesterolo LDL (mg / dL) | (N = 119) | (N = 113) | (N = 109) | (N = 126) | (N = 117) | (N = 107) |
| Baseline | 131.0 | 134.9 | 135.8 | 125.8 | 131.4 | 131.9 |
| Variazione% media alla VISITA FINALE | -1.4% | -1.6% | -3.5% | -3.3% | -5.5% | 3.2% |
| Colesterolo HDL (mg / dL) | (N = 120) | (N = 108) | (N = 108) | (N = 125) | (N = 117) | (N = 108) |
| Baseline | 40.8 | 41.6 | 40.6 | 40.2 | 42.4 | 39.4 |
| Variazione% media alla VISITA FINALE | 6.2% | 8.6% | 5.5% | 6.1% | 7.1% | 5.8% |
I cambiamenti nei parametri lipidici nello studio precedentemente descritto su Glucophage e Glucophage XR sono mostrati nella Tabella 9.
Tabella 9: Riepilogo delle variazioni percentuali medie dal basale * nelle principali variabili lipidiche alla visita finale (studio di 24 settimane)
| Glucophage | Glucophage XR | ||
|---|---|---|---|
| 500 mg Due volte al giorno |
1000 mg Una volta al giorno |
1500 mg Una volta al giorno |
|
| * Tutti i pazienti trattati con Glucophage 500 mg due volte al giorno al basale | |||
| Colesterolo totale (mg / dL) | (N = 68) | (N = 70) | (N = 66) |
| Baseline | 199.0 | 201.9 | 201.6 |
| Variazione% media alla VISITA FINALE | 0.1% | 1.3% | 0.1% |
| Trigliceridi totali (mg / dL) | (N = 68) | (N = 70) | (N = 66) |
| Baseline | 178.0 | 169.2 | 206.8 |
| Variazione% media alla VISITA FINALE | 6.3% | 25.3% | 33.4% |
| Colesterolo LDL (mg / dL) | (N = 68) | (N = 70) | (N = 66) |
| Baseline | 122.1 | 126.2 | 115.7 |
| Variazione% media alla VISITA FINALE | −1.3% | −3.3% | −3.7% |
| Colesterolo HDL (mg / dL) | (N = 68) | (N = 70) | (N = 65) |
| Baseline | 41.9 | 41.7 | 44.6 |
| Variazione% media alla VISITA FINALE | 4.8% | 1.0% | -2.1% |
Studi clinici pediatrici
In uno studio in doppio cieco, controllato con placebo, su pazienti pediatrici di età compresa tra 10 e 16 anni con diabete di tipo 2 (FPG medio 182,2 mg / dL), trattamento con Glucophage (fino a 2000 mg / die) per un massimo di 16 settimane (durata media del trattamento 11 settimane) ha determinato una significativa riduzione netta media di FPG di 64,3 mg / dL, rispetto al placebo (vedere Tabella 10).
Tabella 10: Glucophage vs Placebo (Pediatriaun') Riepilogo delle variazioni medie rispetto al basale * del glucosio plasmatico e del peso corporeo alla visita finale
| Glucophage | Placebo | p-Valore | |
|---|---|---|---|
| un' I pazienti pediatrici hanno un'età media di 13,8 anni (intervallo 10-16 anni) | |||
| * Tutti i pazienti in terapia dietetica al basale | |||
| ** Non statisticamente significativo | |||
| FPG (mg / dL) | (N = 37) | (N = 36) | |
| Baseline Modifica a FINAL VISIT |
162.4 -42.9 |
192.3 21.4 |
<0.001 |
| Peso corporeo (libbre) | (N = 39) | (N = 38) | |
| Baseline Modifica a FINAL VISIT |
205.3 -3.3 |
189.0 -2.0 |
NS ** |
superiore
Indicazioni e utilizzo
Le compresse di glucofago (metformina cloridrato) sono indicate in aggiunta alla dieta e all'esercizio fisico per migliorare il controllo glicemico negli adulti e nei bambini con diabete mellito di tipo 2.
Glucophage XR (metformin hydrochloride) Compresse a rilascio prolungato è indicato in aggiunta alla dieta e all'esercizio fisico per migliorare il controllo glicemico negli adulti con diabete mellito di tipo 2.
superiore
Controindicazioni
Glucophage e Glucophage XR sono controindicati in pazienti con:
Malattia renale o disfunzione renale (ad es., Come suggerito dai livelli sierici di creatinina - 1,5 mg / dL [maschi], - 1,4 mg / dL [femmine] o anormali clearance della creatinina) che può anche derivare da condizioni come collasso cardiovascolare (shock), infarto miocardico acuto e setticemia (vedere AVVERTENZE e PRECAUZIONI).
Ipersensibilità nota alla metformina cloridrato.
Acidosi metabolica acuta o cronica, compresa la chetoacidosi diabetica, con o senza coma. La chetoacidosi diabetica deve essere trattata con insulina.
Glucophage e Glucophage XR devono essere temporaneamente sospesi nei pazienti sottoposti a studi radiologici che coinvolgono somministrazione intravascolare di materiali di contrasto iodati, poiché l'uso di tali prodotti può comportare un'alterazione acuta di funzione renale. (Guarda anche PRECAUZIONI.)
superiore
Avvertenze
Acidosi lattica:
L'acidosi lattica è una complicanza metabolica rara, ma grave, che può verificarsi a causa dell'accumulo di metformina durante il trattamento con Glucophage o Glucophage XR; quando si verifica, è fatale in circa il 50% dei casi. L'acidosi lattica può verificarsi anche in associazione a una serie di condizioni patofisiologiche, incluso il diabete mellito, e ogni volta che vi è una significativa ipoperfusione dei tessuti e ipossiemia. L'acidosi lattica è caratterizzata da elevati livelli di lattato nel sangue (> 5 mmol / L), diminuzione del pH del sangue, disturbi elettrolitici con un aumento del gap anionico e un rapporto lattato / piruvato aumentato. Quando la metformina è implicata come causa dell'acidosi lattica, si trovano generalmente livelli plasmatici di metformina> 5 µg / mL.
L'incidenza riportata di acidosi lattica nei pazienti trattati con metformina cloridrato è molto bassa (circa 0,03 casi / 1000 anni-paziente, con circa 0,015 casi fatali / 1000 pazienti-anno). In oltre 20.000 pazienti-anni di esposizione alla metformina negli studi clinici, non sono stati segnalati casi di acidosi lattica. Casi segnalati si sono verificati principalmente in pazienti diabetici con insufficienza renale significativa, inclusi entrambi a livello renale intrinseco malattia e ipoperfusione renale, spesso nel contesto di molteplici problemi medico / chirurgici concomitanti e concomitanti multipli farmaci. Pazienti con insufficienza cardiaca congestizia che richiedono una gestione farmacologica, in particolare quelli con instabilità o insufficienza cardiaca congestizia acuta che sono a rischio di ipoperfusione e ipossiemia, sono ad aumentato rischio di lattazione acidosi. Il rischio di acidosi lattica aumenta con il grado di disfunzione renale e l'età del paziente. Pertanto, il rischio di acidosi lattica può essere significativamente ridotto monitorando regolarmente la funzionalità renale pazienti che assumono Glucophage o Glucophage XR e mediante l'uso della dose minima efficace di Glucophage o Glucophage XR. In particolare, il trattamento degli anziani deve essere accompagnato da un attento monitoraggio della funzionalità renale. Il trattamento con Glucophage o Glucophage XR non deve essere iniziato in pazienti di età 80 80 anni a meno che la misurazione della creatinina la clearance dimostra che la funzionalità renale non è ridotta, poiché questi pazienti sono più sensibili allo sviluppo della lattica acidosi. Inoltre, Glucophage e Glucophage XR devono essere prontamente trattenuti in presenza di qualsiasi condizione associata a ipossiemia, disidratazione o sepsi. Poiché la funzionalità epatica compromessa può limitare significativamente la capacità di eliminare lattato, glucofago e Glucophage XR deve essere generalmente evitato in pazienti con evidenza clinica o di laboratorio di epatica malattia. I pazienti devono essere avvertiti contro l'assunzione eccessiva di alcol, acuta o cronica, durante l'assunzione Glucophage o Glucophage XR, poiché l'alcol potenzia gli effetti della metformina cloridrato sul lattato metabolismo. Inoltre, Glucophage e Glucophage XR devono essere temporaneamente sospesi prima di qualsiasi studio di radiocontrasto intravascolare e per qualsiasi procedura chirurgica (vedere anche PRECAUZIONI).
L'inizio dell'acidosi lattica è spesso sottile e accompagnato solo da sintomi non specifici come malessere, mialgie, difficoltà respiratoria, aumento della sonnolenza e sofferenza addominale aspecifica. Ci possono essere associati ipotermia, ipotensione e bradiaritmie resistenti con acidosi più marcata. Il paziente e il medico del paziente devono essere consapevoli della possibile importanza di tali sintomi e il paziente deve essere istruito a informare immediatamente il medico se si verificano (vedere anche PRECAUZIONI). Glucophage e Glucophage XR devono essere ritirati fino a quando la situazione non viene chiarita. Possono essere utili elettroliti sierici, chetoni, glucosio nel sangue e, se indicato, pH del sangue, livelli di lattato e persino livelli di metformina nel sangue. Una volta che un paziente è stabilizzato a qualsiasi livello di dose di Glucophage o Glucophage XR, è improbabile che i sintomi gastrointestinali, che sono comuni all'inizio della terapia, siano correlati al farmaco. La comparsa successiva di sintomi gastrointestinali potrebbe essere dovuta all'acidosi lattica o ad altre malattie gravi.
I livelli di lattato plasmatico venoso a digiuno al di sopra del limite superiore del normale ma inferiore a 5 mmol / L nei pazienti che assumono Glucophage o Glucophage XR non indicano necessariamente acidosi lattica imminente e può essere spiegabile con altri meccanismi, come diabete o obesità scarsamente controllati, attività fisica vigorosa o problemi tecnici nel campione la manipolazione. (Guarda anche PRECAUZIONI.)
L'acidosi lattica deve essere sospettata in tutti i pazienti diabetici con acidosi metabolica priva di evidenza di chetoacidosi (chetonuria e chetonemia).
L'acidosi lattica è un'emergenza medica che deve essere curata in ambito ospedaliero. In un paziente con acidosi lattica che sta assumendo Glucophage o Glucophage XR, il farmaco deve essere immediatamente sospeso e devono essere istituite prontamente misure di supporto generali. Perché la metformina cloridrato è dializzabile (con una clearance fino a 170 ml / min in buone condizioni emodinamiche condizioni), si raccomanda una pronta emodialisi per correggere l'acidosi e rimuovere l'accumulo metformina. Tale gestione comporta spesso una pronta inversione dei sintomi e il recupero. (Guarda anche CONTROINDICAZIONI e PRECAUZIONI.)
superiore
Precauzioni
Generale
Esiti macrovascolari: non sono stati condotti studi clinici che stabiliscano prove conclusive della riduzione del rischio macrovascolare con Glucophage o Glucophage XR o qualsiasi altro farmaco antidiabetico.
Monitoraggio della funzionalità renale: è noto che la metformina viene sostanzialmente escreta dal rene e dalla il rischio di accumulo di metformina e acidosi lattica aumenta con il grado di compromissione della funzionalità renale funzione. Pertanto, i pazienti con livelli sierici di creatinina al di sopra del limite superiore della norma per la loro età non devono ricevere Glucophage o Glucophage XR. Nei pazienti con età avanzata, Glucophage e Glucophage XR devono essere attentamente titolati per stabilire la dose minima per un adeguato effetto glicemico, poiché l'invecchiamento è associato a una ridotta funzionalità renale funzione. Nei pazienti anziani, in particolare quelli con più di 80 anni di età, la funzionalità renale deve essere monitorata regolarmente e, in generale, Glucophage e Glucophage XR non devono essere titolati alla dose massima (vedere AVVERTENZE e DOSAGGIO E SOMMINISTRAZIONE).
Prima di iniziare la terapia con Glucophage o Glucophage XR e almeno successivamente ogni anno, la funzionalità renale deve essere valutata e verificata normalmente. Nei pazienti in cui è previsto lo sviluppo di disfunzione renale, deve essere valutata la funzionalità renale più frequentemente e Glucophage o Glucophage XR hanno interrotto la comparsa di evidenza di insufficienza renale presente.
Uso di farmaci concomitanti che possono influenzare la funzionalità renale o la disposizione della metformina: medicinali concomitanti che possono influenzare la funzionalità renale o provocare significativo cambiamento emodinamico o può interferire con la disposizione della metformina, come i farmaci cationici che vengono eliminati dalla secrezione tubulare renale (vedere PRECAUZIONI: Interazioni farmacologiche), deve essere usato con cautela.
Studi radiologici che prevedono l'uso di materiali di contrasto iodati per via endovenosa (ad esempio urogramma endovenoso, endovenoso scansioni colangiografiche, angiografiche e di tomografia computerizzata (TC) con materiali di contrasto intravascolare): studi di contrasto intra-vascolare con i materiali iodati possono portare a un'alterazione acuta della funzionalità renale e sono stati associati all'acidosi lattica nei pazienti trattati metformina (vedi CONTROINDICAZIONI). Pertanto, nei pazienti in cui è previsto tale studio, Glucophage o Glucophage XR devono essere temporaneamente sospesi al momento o prima della e trattenuta per 48 ore successive alla procedura e ripristinata solo dopo che la funzione renale è stata rivalutata e trovata essere normale.
Stati ipossici: collasso cardiovascolare (shock) per qualsiasi causa, insufficienza cardiaca congestizia acuta, miocardio acuto l'infarto e altre condizioni caratterizzate da ipossiemia sono stati associati all'acidosi lattica e possono anche causare azotemia prerenale. Quando si verificano tali eventi in pazienti in terapia con Glucophage o Glucophage XR, il farmaco deve essere prontamente sospeso.
Procedure chirurgiche: la terapia con Glucophage o Glucophage XR deve essere temporaneamente sospesa per qualsiasi procedura chirurgica (tranne le procedure minori non associate con assunzione limitata di cibo e liquidi) e non deve essere riavviato fino a quando l'assunzione orale del paziente non è stata ripresa e la funzione renale non è stata valutata come normale.
Assunzione di alcol: è noto che l'alcol potenzia l'effetto della metformina sul metabolismo del lattato. I pazienti, pertanto, devono essere avvertiti dall'assunzione eccessiva di alcol, acuta o cronica, durante il trattamento con Glucophage o Glucophage XR.
Compromissione della funzionalità epatica: poiché la compromissione della funzionalità epatica è stata associata ad alcuni casi di acidosi lattica, Glucophage e Glucophage XR devono essere generalmente evitati in pazienti con evidenza clinica o di laboratorio di malattia.
Livelli di vitamina B12: negli studi clinici controllati su Glucophage della durata di 29 settimane, una riduzione ai livelli subnormali di livelli di vitamina B12 sierici precedentemente normali, senza manifestazioni cliniche, sono stati osservati in circa il 7% di pazienti. Tale riduzione, probabilmente dovuta all'interferenza con l'assorbimento di B12 da parte del complesso del fattore intrinseco B12, è tuttavia molto raramente associato ad anemia e sembra essere rapidamente reversibile con l'interruzione del glucofago o della vitamina B12 supplementazione. La misurazione dei parametri ematologici su base annuale è consigliata nei pazienti con Glucophage o Glucophage XR e qualsiasi anomalia apparente deve essere opportunamente investigata e gestita (vedere PRECAUZIONI: Test di laboratorio).
Alcuni individui (quelli con insufficiente vitamina B12 o assunzione o assorbimento di calcio) sembrano predisposti allo sviluppo di livelli di vitamina B12 non normali. In questi pazienti possono essere utili misurazioni di routine della vitamina B12 nel siero ad intervalli di 2-3 anni.
Modifica dello stato clinico dei pazienti con diabete di tipo 2 precedentemente controllato: un paziente con diabete di tipo 2 precedentemente ben controllato con Glucophage o Glucophage XR che sviluppa anomalie di laboratorio o malattie cliniche (in particolare malattie vaghe e mal definite) devono essere prontamente valutate per l'evidenza di chetoacidosi o lattica acidosi. La valutazione dovrebbe includere elettroliti sierici e chetoni, glicemia e, se indicato, livelli ematici di pH, lattato, piruvato e metformina. In caso di acidosi di entrambe le forme, Glucophage o Glucophage XR devono essere immediatamente interrotti e devono essere avviate altre misure correttive appropriate (vedere anche AVVERTENZE).
Ipoglicemia: l'ipoglicemia non si verifica nei pazienti che assumono Glucophage o Glucophage XR da soli nelle normali circostanze d'uso, ma potrebbe verificarsi quando l'apporto calorico è carente, quando l'esercizio fisico intenso non è compensato dalla supplementazione calorica o durante l'uso concomitante con altri agenti ipoglicemizzanti (come sulfoniluree e insulina) o etanolo.
I pazienti anziani, debilitati o malnutriti e quelli con insufficienza surrenalica o ipofisaria o intossicazione da alcol sono particolarmente sensibili agli effetti ipoglicemizzanti. L'ipoglicemia può essere difficile da riconoscere negli anziani e nelle persone che assumono farmaci bloccanti beta-adrenergici.
Perdita di controllo della glicemia: quando un paziente stabilizzato su qualsiasi regime diabetico è esposto a stress come febbre, traumi, infezioni o interventi chirurgici, può verificarsi una temporanea perdita di controllo glicemico. In tali momenti, potrebbe essere necessario trattenere Glucophage o Glucophage XR e somministrare temporaneamente insulina. Glucophage o Glucophage XR possono essere ripristinati dopo che l'episodio acuto è stato risolto.
L'efficacia dei farmaci antidiabetici orali nel ridurre la glicemia a un livello mirato diminuisce in molti pazienti per un periodo di tempo. Questo fenomeno, che può essere dovuto alla progressione della malattia di base o alla ridotta reattività al farmaco, è noto come fallimento secondario, per distinguerlo dal fallimento primario in cui il farmaco è inefficace durante la terapia iniziale. In caso di insuccesso secondario con Glucophage o Glucophage XR o monoterapia con sulfonilurea, la terapia combinata con Glucophage o Glucophage XR e sulfonilurea può dare una risposta. In caso di insuccesso secondario con la terapia combinata con Glucophage / sulfonylurea o Glucophage Terapia con XR / sulfonilurea, potrebbe essere necessario prendere in considerazione alternative terapeutiche incluso l'inizio di terapia insulinica.
Informazioni per i pazienti
I pazienti devono essere informati dei potenziali rischi e benefici di Glucophage o Glucophage XR e delle modalità alternative di terapia. Dovrebbero anche essere informati dell'importanza dell'adesione alle istruzioni dietetiche, di un esercizio regolare programma e di test regolari della glicemia, dell'emoglobina glicosilata, della funzionalità renale e dell'ematologia parametri.
I rischi di acidosi lattica, i suoi sintomi e le condizioni che predispongono al suo sviluppo, come notato nel AVVERTENZE e PRECAUZIONI sezioni, dovrebbero essere spiegate ai pazienti. I pazienti devono essere avvisati di interrompere immediatamente Glucophage o Glucophage XR e di comunicare tempestivamente la propria salute medico se iperventilazione inspiegabile, mialgia, malessere, sonnolenza insolita o altri sintomi aspecifici si verificano. Una volta che un paziente è stabilizzato a qualsiasi livello di dose di Glucophage o Glucophage XR, è improbabile che i sintomi gastrointestinali, che sono comuni all'inizio della terapia con metformina, siano correlati al farmaco. La comparsa successiva di sintomi gastrointestinali potrebbe essere dovuta all'acidosi lattica o ad altre malattie gravi.
I pazienti devono essere informati sull'assunzione eccessiva di alcol, acuta o cronica, durante il trattamento con Glucophage o Glucophage XR.
Glucophage o Glucophage XR da soli di solito non causano ipoglicemia, sebbene possa verificarsi quando Glucophage o Glucophage XR sono usati in associazione con sulfoniluree orali e insulina. Quando si inizia la terapia di combinazione, i rischi di ipoglicemia, i suoi sintomi e il trattamento e le condizioni che predispongono al suo sviluppo dovrebbero essere spiegate ai pazienti e alla famiglia responsabile membri.
I pazienti devono essere informati che Glucophage XR deve essere deglutito intero e non schiacciato o masticato, e che il ingredienti inattivi possono essere occasionalmente eliminati nelle feci come una massa morbida che può assomigliare all'originale tavoletta.
Test di laboratorio
La risposta a tutte le terapie diabetiche deve essere monitorata mediante misurazioni periodiche del sangue a digiuno livelli di glucosio e glicosilato di emoglobina, con l'obiettivo di ridurre questi livelli verso il normale gamma. Durante la titolazione della dose iniziale, è possibile utilizzare la glicemia a digiuno per determinare la risposta terapeutica. Successivamente, devono essere monitorati sia il glucosio che l'emoglobina glicosilata. Le misurazioni dell'emoglobina glicosilata possono essere particolarmente utili per la valutazione del controllo a lungo termine (vedere anche DOSAGGIO E SOMMINISTRAZIONE).
Monitoraggio iniziale e periodico dei parametri ematologici (ad es. Emoglobina / ematocrito e sangue rosso) indici cellulari) e funzione renale (creatinina sierica), almeno su base annuale. Mentre la megaloblasticanemia è stata osservata raramente con la terapia con Glucophage, se questo è sospettato, la carenza di vitamina B12 dovrebbe essere esclusa.
Interazioni farmacologiche (valutazione clinica delle interazioni farmacologiche condotte con glucofago)
Glyburide: in uno studio di interazione a dose singola in pazienti con diabete di tipo 2, la somministrazione concomitante di la metformina e il gliburide non hanno comportato variazioni nella farmacocinetica della metformina o farmacodinamica. Sono state osservate diminuzioni dell'AUC e della Cmax del gliburide, ma sono state altamente variabili. La natura monodose di questo studio e la mancanza di correlazione tra i livelli ematici di gliburide e gli effetti farmacodinamici, rende incerto il significato clinico di questa interazione (vedere DOSAGGIO E SOMMINISTRAZIONE: Concomitante terapia con Glucophage o Glucophage XR e Oral Sulfonylurea in pazienti adulti).
Furosemide: uno studio di interazione farmacologica a dose singola di metformina-furosemide in soggetti sani ha dimostrato che i parametri farmacocinetici di entrambi i composti sono stati influenzati dalla somministrazione concomitante. La furosemide ha aumentato il plasma della metformina e la Cmax del sangue del 22% e l'AUC del sangue del 15%, senza alcun cambiamento significativo nella clearance renale della metformina. Quando somministrati con metformina, la Cmax e l'AUC della furosemide erano rispettivamente più piccole del 31% e del 12% rispetto a quando somministrato da solo e l'emivita terminale è stata ridotta del 32%, senza alcun cambiamento significativo nella furosemide renale spazio. Non sono disponibili informazioni sull'interazione di metformina e furosemide quando somministrate in modo cronico.
Nifedipina: uno studio di interazione farmacologica a dose singola, metformina-nifedipina in volontari sani normali ha dimostrato che la somministrazione concomitante di nifedipina ha aumentato la metformina Cmax e l'AUC nel plasma rispettivamente del 20% e del 9% e ha aumentato la quantità escreto nelle urine. Tmax e emivita non sono stati influenzati. La nifedipina sembra migliorare l'assorbimento della metformina. La metformina ha avuto effetti minimi sulla nifedipina.
Farmaci cationici: farmaci cationici (ad es. Amiloride, digossina, morfina, procainamide, chinidina, chinino, ranitidina, triamterene, trimetoprim o vancomicina) che sono eliminati dalla secrezione tubulare renale teoricamente hanno il potenziale per l'interazione con metformina competendo per il trasporto tubulare renale comune sistemi. Tale interazione tra metformina e cimetidina orale è stata osservata in volontari sani normali in metformina-cimetidina a dose singola e multipla studi di interazione farmacologica, con un aumento del 60% del picco della metformina nel plasma e delle concentrazioni di sangue intero e un aumento del 40% nel plasma e della metformina del sangue intero AUC. Non è stato osservato alcun cambiamento nell'emivita di eliminazione nello studio con dose singola. La metformina non ha avuto effetti sulla farmacocinetica della cimetidina. Sebbene tali interazioni rimangano teoriche (ad eccezione della cimetidina), un attento monitoraggio del paziente e un aggiustamento della dose di Glucophage o Glucophage XR e / o il farmaco interferente è raccomandato nei pazienti che assumono farmaci cationici che vengono escreti attraverso la secrezione tubulare renale prossimale sistema.
Altro: alcuni farmaci tendono a produrre iperglicemia e possono portare alla perdita di controllo glicemico. Questi farmaci includono i tiazidici e altri diuretici, corticosteroidi, fenotiazine, prodotti tiroidei, estrogeni, contraccettivi orali, fenitoina, acido nicotinico, simpaticomimetici, farmaci bloccanti i canali del calcio e isoniazide. Quando tali farmaci vengono somministrati a un paziente che riceve Glucophage o Glucophage XR, il paziente deve essere attentamente osservato per la perdita di controllo della glicemia. Quando tali farmaci vengono ritirati da un paziente che riceve Glucophage o Glucophage XR, il paziente deve essere attentamente osservato per l'ipoglicemia.
In volontari sani, la farmacocinetica di metformina e propranololo e metformina e ibuprofene non sono state influenzate quando somministrate in concomitanza con studi di interazione a dose singola.
La metformina è legata in modo trascurabile alle proteine plasmatiche ed è quindi meno probabile che interagisca con farmaci altamente legati alle proteine come salicilati, sulfamidici, cloramfenicolo e probenecid, rispetto alle sulfoniluree, che sono ampiamente legate al siero proteine.
Cancerogenesi, mutagenesi, alterazione della fertilità
Sono stati condotti studi di carcinogenicità a lungo termine nei ratti (durata della somministrazione di 104 settimane) e nei topi (durata della dose di 91 settimane) a dosi fino a 900 mg / kg / giorno e 1500 mg / kg / giorno inclusi, rispettivamente. Queste dosi sono entrambe circa 4 volte la dose massima giornaliera raccomandata nell'uomo di 2000 mg sulla base dei confronti della superficie corporea. Nessuna prova di cancerogenicità con metformina è stata trovata in topi maschi o femmine. Allo stesso modo, non è stato osservato potenziale tumorigenico con metformina nei ratti maschi. Vi è stata, tuttavia, un'aumentata incidenza di polipi uterini stromali benigni nei ratti trattati con 900 mg / kg / die.
Non ci sono prove di un potenziale mutageno della metformina nei seguenti test in vitro: test di Ames (S. typhimurium), test di mutazione genica (cellule di linfoma di topo) o test di aberrazioni cromosomiche (linfociti umani). Anche i risultati del test del micronucleo su topo in vivo erano negativi.
La fertilità di ratti maschi o femmine non è stata influenzata dalla metformina quando somministrato a dosi fino a 600 mg / kg / die, che è circa 3 volte la dose giornaliera massima raccomandata nell'uomo in base alla superficie corporea confronti.
Gravidanza
Effetti teratogeni: gravidanza categoria B
Informazioni recenti suggeriscono fortemente che livelli anormali di glicemia durante la gravidanza sono associati a una maggiore incidenza di anomalie congenite. La maggior parte degli esperti consiglia di utilizzare l'insulina durante la gravidanza per mantenere i livelli di glucosio nel sangue il più vicino possibile al normale. Poiché gli studi sulla riproduzione animale non sono sempre predittivi della risposta umana, Glucophage e Glucophage XR non devono essere utilizzati durante la gravidanza se non in caso di assoluta necessità.
Non esistono studi adeguati e ben controllati su donne in gravidanza con Glucophage o Glucophage XR. La metformina non era teratogena nei ratti e nei conigli a dosi fino a 600 mg / kg / die. Ciò rappresenta un'esposizione di circa 2 e 6 volte la dose massima giornaliera raccomandata nell'uomo di 2000 mg in base al confronto della superficie corporea rispettivamente per ratti e conigli. La determinazione delle concentrazioni fetali ha dimostrato una parziale barriera placentare alla metformina.
Madri che allattano
Gli studi sui ratti in allattamento mostrano che la metformina viene escreta nel latte e raggiunge livelli paragonabili a quelli nel plasma. Studi simili non sono stati condotti su madri che allattano. Poiché esiste il potenziale di ipoglicemia nei lattanti, è necessario decidere se farlo interrompere l'allattamento o interrompere il farmaco, tenendo conto dell'importanza del farmaco per il madre. Se il glucosio o il glucosio XR vengono interrotti e se la sola dieta non è adeguata per il controllo della glicemia, si deve prendere in considerazione la terapia insulinica.
Uso pediatrico
La sicurezza e l'efficacia di Glucophage per il trattamento del diabete di tipo 2 sono state stabilite in pazienti pediatrici di età compresa tra 10 e 16 anni (non sono stati condotti studi su pazienti pediatrici di età inferiore ai 10 anni anni). L'uso di Glucophage in questa fascia d'età è supportato da prove di studi adeguati e ben controllati su Glucophage negli adulti con dati aggiuntivi da un studio clinico controllato su pazienti pediatrici di età compresa tra 10 e 16 anni con diabete di tipo 2, che ha dimostrato una risposta simile nel controllo glicemico a quella osservata in adulti. (Vedere FARMACOLOGIA CLINICA: Studi clinici pediatrici.) In questo studio, gli effetti avversi erano simili a quelli descritti negli adulti. (Vedere REAZIONI AVVERSE: Pazienti pediatrici.) Si raccomanda una dose massima giornaliera di 2000 mg. (Vedere DOSAGGIO E SOMMINISTRAZIONE: Programma posologico raccomandato: Pediatria.)
La sicurezza e l'efficacia di Glucophage XR nei pazienti pediatrici non sono state stabilite.
Uso geriatrico
Gli studi clinici controllati su Glucophage e Glucophage XR non hanno incluso un numero sufficiente di pazienti anziani per determinare se rispondono diversamente dai pazienti più giovani, sebbene altre esperienze cliniche riportate non abbiano identificato differenze nelle risposte tra anziani e giovani pazienti. È noto che la metformina viene sostanzialmente escreta dal rene e poiché il rischio di gravi reazioni avverse al farmaco è maggiore in pazienti con compromissione della funzionalità renale, Glucophage e Glucophage XR devono essere utilizzati solo in pazienti con funzionalità renale normale (vedere CONTROINDICAZIONI, AVVERTENZE, e FARMACOLOGIA CLINICA: Farmacocinetica). Poiché l'invecchiamento è associato a ridotta funzionalità renale, Glucophage o Glucophage XR devono essere usati con cautela all'aumentare dell'età. Prestare attenzione nella selezione della dose e basarsi su un attento e regolare monitoraggio della funzionalità renale. In generale, i pazienti anziani non devono essere titolati alla dose massima di Glucophage o Glucophage XR (vedere anche AVVERTENZE e DOSAGGIO E SOMMINISTRAZIONE).
superiore
Reazioni avverse
In uno studio clinico in doppio cieco statunitense su Glucophage in pazienti con diabete di tipo 2, un totale di 141 pazienti hanno ricevuto terapia con Glucophage (fino a 2550 mg al giorno) e 145 pazienti hanno ricevuto placebo. Le reazioni avverse riportate in oltre il 5% dei pazienti con glucofago e che erano più comuni nei pazienti trattati con glucofago rispetto ai pazienti trattati con placebo, sono elencate nella Tabella 11.
Tabella 11: reazioni avverse più comuni (> 5,0 per cento) in uno studio clinico controllato con placebo sulla monoterapia con glucofago *
| Reazione avversa | Glucophage monoterapia (N = 141) |
Placebo (N = 145) |
|---|---|---|
| % di pazienti | ||
| * Reazioni più comuni nei pazienti trattati con Glucophage rispetto a quelli trattati con placebo. | ||
| Diarrea | 53.2 | 11.7 |
| Nausea | 25.5 | 8.3 |
| Flatulenza | 12.1 | 5.5 |
| Astenia | 9.2 | 5.5 |
| Indigestione | 7.1 | 4.1 |
| Disagio addominale | 6.4 | 4.8 |
| Mal di testa | 5.7 | 4.8 |
La diarrea ha portato alla sospensione del trattamento in studio nel 6% dei pazienti trattati con Glucophage. Inoltre, sono state riportate le seguenti reazioni avverse in 1.0 ¥ 1,0% a 55,0% dei pazienti con glucofago e sono state riportate più comunemente con Glucophage rispetto al placebo: feci anormali, ipoglicemia, mialgia, vertigini, dispnea, disfunzione delle unghie, eruzione cutanea, aumento della sudorazione, disturbi del gusto, fastidio al torace, brividi, sindrome influenzale, arrossamento, palpitazione.
Negli studi clinici in tutto il mondo oltre 900 pazienti con diabete di tipo 2 sono stati trattati con Glucophage XR in studi controllati con placebo e attivi. Negli studi controllati con placebo, 781 pazienti hanno ricevuto Glucophage XR e 195 pazienti hanno ricevuto placebo. Le reazioni avverse riportate in più del 5% dei pazienti con Glucophage XR e che erano più comuni nei pazienti trattati con Glucophage XR rispetto ai pazienti trattati con placebo, sono elencate nella Tabella 12.
Tabella 12: reazioni avverse più comuni (> 5,0 per cento) negli studi controllati con placebo di Glucophage XR *
| Reazione avversa | Glucophage XR (N = 781) |
Placebo (N = 195) |
|---|---|---|
| % di pazienti | ||
| * Reazioni più comuni nei pazienti trattati con Glucophage XR rispetto ai pazienti trattati con placebo. | ||
| Diarrea | 9.6 | 2.6 |
| Nausea | 6.5 | 1.5 |
La diarrea ha portato alla sospensione del trattamento in studio nello 0,6% dei pazienti trattati con Glucophage XR. Inoltre, le seguenti reazioni avverse sono state riportate in 1.0 ¥ 1,0% a 55,0% dei pazienti con Glucophage XR ed erano più comunemente riportate con Glucophage XR rispetto al placebo: dolore addominale, costipazione, distensione addome, dispepsia / bruciore di stomaco, flatulenza, vertigini, mal di testa, infezione delle vie respiratorie superiori, gusto disturbo.
Pazienti pediatrici
Negli studi clinici con Glucophage in pazienti pediatrici con diabete di tipo 2, il profilo delle reazioni avverse è stato simile a quello osservato negli adulti.
superiore
Overdose
Si è verificato un sovradosaggio di metformina cloridrato, inclusa l'ingestione di quantità superiori a 50 grammi. Ipoglicemia è stata riportata in circa il 10% dei casi, ma non è stata stabilita alcuna associazione causale con metformina cloridrato. L'acidosi lattica è stata riportata in circa il 32% dei casi di sovradosaggio da metformina (vedere AVVERTENZE). La metformina è dializzabile con una clearance fino a 170 ml / min in buone condizioni emodinamiche. Pertanto, l'emodialisi può essere utile per la rimozione del farmaco accumulato da pazienti in cui si sospetta un sovradosaggio di metformina.
superiore
Dosaggio e amministrazione
Non esiste un regime posologico fisso per la gestione dell'iperglicemia nei pazienti con diabete di tipo 2 con Glucophage o Glucophage XR o qualsiasi altro agente farmacologico. Il dosaggio di Glucophage o Glucophage XR deve essere individualizzato sulla base sia dell'efficacia che della tolleranza, senza superare le dosi giornaliere massime raccomandate. La dose giornaliera massima raccomandata di Glucophage è 2550 mg negli adulti e 2000 mg nei pazienti pediatrici (10-16 anni di età); la dose giornaliera massima raccomandata di Glucophage XR negli adulti è di 2000 mg.
Glucophage deve essere somministrato in dosi divise con i pasti mentre Glucophage XR deve essere generalmente somministrato una volta al giorno durante il pasto serale. Glucophage o Glucophage XR deve essere iniziato a una dose bassa, con graduale aumento della dose, entrambi per ridurre effetti collaterali gastrointestinali e per consentire l'identificazione della dose minima richiesta per un adeguato controllo glicemico del paziente.
Durante l'inizio del trattamento e la titolazione della dose (vedere lo Schema posologico raccomandato di seguito), deve essere presente glicemia a digiuno utilizzato per determinare la risposta terapeutica a Glucophage o Glucophage XR e identificare la dose minima efficace per la paziente. Successivamente, l'emoglobina glicosilata deve essere misurata ad intervalli di circa 3 mesi. L'obiettivo terapeutico dovrebbe essere quello di ridurre i livelli di glicemia a digiuno e di glicosilato glicemico a livelli normali o quasi normali di utilizzando la dose minima efficace di Glucophage o Glucophage XR, sia in monoterapia che in associazione con sulfonilurea o insulina.
Il monitoraggio della glicemia e dell'emoglobina glicosilata consentirà anche il rilevamento di insufficienza primaria, ovvero un abbassamento inadeguato della glicemia a livello dose massima raccomandata di farmaco e fallimento secondario, cioè perdita di un'adeguata risposta ipoglicemizzante dopo un periodo iniziale di efficacia.
La somministrazione a breve termine di Glucophage o Glucophage XR può essere sufficiente durante i periodi di perdita transitoria del controllo nei pazienti generalmente ben controllati con la sola dieta.
Le compresse di Glucophage XR devono essere deglutite intere e mai frantumate o masticate. Occasionalmente, gli ingredienti inattivi di Glucophage XR saranno eliminati nelle feci come una massa morbida e idratata.
Programma di dosaggio raccomandato
adulti
In generale, non si osservano risposte clinicamente significative a dosi inferiori a 1500 mg al giorno. Tuttavia, si consiglia una dose iniziale raccomandata inferiore e un dosaggio gradualmente aumentato per ridurre al minimo i sintomi gastrointestinali.
La dose iniziale abituale di Glucophage (metformina cloridrato) è di 500 mg due volte al giorno o 850 mg una volta al giorno, somministrata durante i pasti. Gli aumenti del dosaggio devono essere effettuati con incrementi di 500 mg settimanali o 850 mg ogni 2 settimane, fino a un totale di 2000 mg al giorno, somministrati in dosi divise. I pazienti possono anche essere titolati da 500 mg due volte al giorno a 850 mg due volte al giorno dopo 2 settimane. Per quei pazienti che richiedono un ulteriore controllo glicemico, il glucofago può essere somministrato ad una dose massima giornaliera di 2550 mg al giorno. Dosi superiori a 2000 mg possono essere meglio tollerate somministrate 3 volte al giorno durante i pasti.
La dose iniziale abituale di Glucophage XR (metformina cloridrato) compresse a rilascio prolungato è di 500 mg una volta al giorno durante il pasto serale. Gli aumenti del dosaggio devono essere effettuati con incrementi di 500 mg a settimana, fino a un massimo di 2000 mg una volta al giorno con il pasto serale. Se il controllo glicemico non viene raggiunto con Glucophage XR 2000 mg una volta al giorno, deve essere preso in considerazione uno studio con Glucophage XR 1000 mg due volte al giorno. Se sono necessarie dosi più elevate di metformina, Glucophage deve essere usato a dosi giornaliere totali fino a 2550 mg somministrate in dosi giornaliere suddivise, come descritto sopra. (Vedere FARMACOLOGIA CLINICA: Studi clinici.)
In uno studio randomizzato, i pazienti attualmente trattati con Glucophage sono passati a Glucophage XR. I risultati di questo studio suggeriscono che i pazienti in trattamento con Glucophage possono passare in sicurezza a Glucophage XR una volta al giorno alla stessa dose giornaliera totale, fino a 2000 mg una volta al giorno. Dopo il passaggio da Glucophage a Glucophage XR, il controllo glicemico deve essere attentamente monitorato e gli aggiustamenti del dosaggio devono essere effettuati di conseguenza (vedere FARMACOLOGIA CLINICA: Studi clinici).
Pediatria
La dose iniziale abituale di Glucophage è di 500 mg due volte al giorno, somministrata durante i pasti. Gli aumenti del dosaggio devono essere effettuati con incrementi di 500 mg settimanali fino a un massimo di 2000 mg al giorno, somministrati in dosi divise. La sicurezza e l'efficacia di Glucophage XR nei pazienti pediatrici non sono state stabilite.
Trasferimento da altra terapia antidiabetica
Quando si trasferiscono pazienti da agenti ipoglicemizzanti orali standard diversi dalla clorpropamide a Glucophage o Glucophage XR, generalmente non è necessario alcun periodo di transizione. Quando si trasferiscono pazienti da clorpropamide, è necessario prestare attenzione durante le prime 2 settimane a causa del ritenzione prolungata di clorpropamide nel corpo, con conseguente sovrapposizione di effetti farmacologici e possibile ipoglicemia.
Concomitante terapia con Glucophage o Glucophage XR e Oral Sulfonylurea in pazienti adulti
Se i pazienti non hanno risposto a 4 settimane della dose massima di Glucophage o Glucophage XR in monoterapia, si deve prendere in considerazione l'aggiunta graduale di una sulfonilurea orale durante il proseguimento di Glucophage o Glucophage XR alla dose massima, anche se la precedente insufficienza primaria o secondaria a una sulfonilurea ha si è verificato. I dati clinici e farmacocinetici di interazione farmaco-farmaco sono attualmente disponibili solo per metformina più glyburide (glibenclamide).
Con la terapia concomitante con Glucophage o Glucophage XR e sulfonilurea, è possibile ottenere il controllo desiderato della glicemia regolando la dose di ciascun farmaco. In uno studio clinico su pazienti con diabete di tipo 2 e precedente insuccesso con glyburide, i pazienti che hanno iniziato a assumere Glucophage 500 mg e glyburide 20 mg sono stati titolati a 1000/20 mg, 1500/20 mg, 2000/20 mg o 2500/20 mg di Glucophage e glyburide, rispettivamente, per raggiungere l'obiettivo del controllo glicemico misurato mediante FPG, HbA1c e risposta al glucosio plasmatico (vedere FARMACOLOGIA CLINICA: Studi clinici). Tuttavia, si dovrebbero tentare di identificare la dose minima efficace di ciascun farmaco per raggiungere questo obiettivo. Con la terapia concomitante con Glucophage o Glucophage XR e sulfonilurea, il rischio di ipoglicemia associato alla terapia con sulfonilurea continua e può essere aumentato. Devono essere prese le precauzioni appropriate. (Vedi foglietto illustrativo della relativa sulfonilurea.)
Se i pazienti non hanno risposto in modo soddisfacente a 1-3 mesi di terapia concomitante con la dose massima di Glucophage o Glucophage XR e il la dose massima di una sulfonilurea orale, considera le alternative terapeutiche compreso il passaggio all'insulina con o senza Glucophage o Glucophage XR.
Concomitante Glucophage o Glucophage XR e terapia insulinica in pazienti adulti
La dose attuale di insulina deve essere continuata all'inizio della terapia con Glucophage o Glucophage XR. La terapia con Glucophage o Glucophage XR deve essere iniziata a 500 mg una volta al giorno nei pazienti in terapia insulinica. Per i pazienti che non rispondono adeguatamente, la dose di Glucophage o Glucophage XR deve essere aumentata di 500 mg dopo circa 1 settimana e di 500 mg ogni settimana da allora in poi fino a quando non si avrà un adeguato controllo glicemico raggiunto. La dose giornaliera massima raccomandata è di 2500 mg per Glucophage e 2000 mg per Glucophage XR. Si raccomanda di ridurre la dose di insulina dal 10% al 25% quando si digiuna glicemia a digiuno le concentrazioni diminuiscono a meno di 120 mg / dL nei pazienti che assumono contemporaneamente insulina e glucofago o Glucophage XR. Ulteriori aggiustamenti dovrebbero essere personalizzati in base alla risposta ipoglicemizzante.
Popolazioni specifiche di pazienti
Glucophage o Glucophage XR non sono raccomandati per l'uso in gravidanza. Il glucofago non è raccomandato nei pazienti di età inferiore ai 10 anni. Glucophage XR non è raccomandato nei pazienti pediatrici (di età inferiore ai 17 anni).
La dose iniziale e di mantenimento di Glucophage o Glucophage XR deve essere conservativa nei pazienti in età avanzata, a causa del potenziale di riduzione della funzionalità renale in questa popolazione. Qualsiasi aggiustamento del dosaggio deve essere basato su un'attenta valutazione della funzionalità renale. Generalmente, i pazienti anziani, debilitati e malnutriti non devono essere titolati alla dose massima di Glucophage o Glucophage XR.
Il monitoraggio della funzionalità renale è necessario per aiutare nella prevenzione dell'acidosi lattica, in particolare negli anziani. (Vedere AVVERTENZE.)
superiore
Come fornito
Glucophage® (metformin hydrochloride) Compresse
| 500 mg | Bottiglie da 100 | NDC 0087-6060-05 |
| 500 mg | Bottiglie da 500 | NDC 0087-6060-10 |
| 850 mg | Bottiglie da 100 | NDC 0087-6070-05 |
| 1000 mg | Bottiglie da 100 | NDC 0087-6071-11 |
Le compresse di Glucophage 500 mg sono compresse rotonde, da bianche a biancastre, rivestite con film con impresso "BMS 6060 "attorno alla periferia del tablet da un lato e" 500 "impresso sulla faccia dell'altro lato.
Le compresse di Glucophage da 850 mg sono compresse rotonde, da bianche a biancastre, rivestite con film con impresso "BMS 6070 "attorno alla periferia del tablet da un lato e" 850 "impresso sulla faccia dell'altro lato.
Le compresse di glucosio da 1000 mg sono compresse bianche, ovali, biconvesse, rivestite con film con "BMS 6071" impresso su un lato e "1000" impresso sul lato opposto e con una linea di bisettrice su entrambi i lati.
Glucophage® XR (metformin hydrochloride) Compresse a rilascio prolungato
| 500 mg | Bottiglie da 100 | NDC 0087-6063-13 |
| 750 mg | Bottiglie da 100 | NDC 0087-6064-13 |
Le compresse di Glucophage XR 500 mg sono compresse di colore da bianco a bianco sporco, a forma di capsula, biconvesse, con "BMS 6063" impresso su un lato e "500" impresso sulla faccia dell'altro lato.
Le compresse di Glucophage XR 750 mg sono compresse a forma di capsula, biconvesse, con "BMS 6064" impresso su un lato e "750" impresso sull'altro lato. Le compresse sono di colore rosso pallido e possono avere un aspetto chiazzato.
Conservazione
Conservare a 20 ° -25 ° C (68 ° -77 ° F); escursioni consentite a 15 ° -30 ° C (59 ° -86 ° F). [Vedi temperatura ambiente controllata USP.]
Distribuire in contenitori resistenti alla luce.
Glucophage® è un marchio registrato di Merck Santà © S.A.S., associato di Merck KGaA di Darmstadt, Germania. Concesso in licenza alla Bristol-Myers Squibb Company.
Distribuito da:
Azienda Bristol-Myers Squibb
Princeton, NJ 08543 USA
ultimo aggiornamento: 01/2009
Glucohage, metformina cloridrato, informazioni per il paziente (in inglese semplice)
Informazioni dettagliate su segni, sintomi, cause, trattamenti del diabete
Le informazioni contenute in questa monografia non intendono coprire tutti i possibili usi, indicazioni, precauzioni, interazioni farmacologiche o effetti avversi. Questa informazione è generalizzata e non è intesa come consulenza medica specifica. Se ha domande sui medicinali che sta assumendo o desidera ulteriori informazioni, consultare il medico, il farmacista o l'infermiere.
torna a: Sfoglia tutti i farmaci per il diabete



