Iloperidone (fanapt) Informazioni di prescrizione complete
Marchio: Fanapt
Nome generico: Iloperidone
Fanapt (Iloperidone) Guida alla prescrizione (PDF)
Contenuti:
Avviso in scatola
Indicazioni e utilizzo
Dosaggio e amministrazione
Controindicazioni
Avvertenze e precauzioni
Reazioni avverse
Interazioni farmacologiche
Utilizzare in popolazioni specifiche
Abuso e dipendenza da droghe
Overdose
Descrizione
Farmacologia clinica
Tossicologia non clinica
Studi clinici
Come fornito
Guida ai farmaci di Brintellix
AVVERTENZA: AUMENTO DELLA MORTALITÀ NEI PAZIENTI ANZIANI CON PSICOSI CORRELATA ALLA DEMENTIA
I pazienti anziani con psicosi correlata alla demenza trattati con farmaci antipsicotici hanno un aumentato rischio di morte. FANAPT non è approvato per il trattamento di pazienti con psicosi correlata alla demenza.
Indicazioni e utilizzo
FANAPT® è indicato per il trattamento della schizofrenia negli adulti.
Nel decidere tra i trattamenti alternativi disponibili per questa condizione, il medico dovrebbe prendere in considerazione la conclusione che FANAPT è associato al prolungamento dell'intervallo QTc. Il prolungamento dell'intervallo QTc è associato in alcuni altri farmaci con la capacità di causare torsione aritmia puntuale, una tachicardia ventricolare polimorfica potenzialmente fatale che può provocare Morte. In molti casi ciò porterebbe alla conclusione che altri farmaci dovrebbero essere provati per primi. Non è ancora noto se FANAPT causerà torsioni di punta o aumenti il tasso di morte improvvisa.
I pazienti devono essere titolati a una dose efficace di FANAPT. Pertanto, il controllo dei sintomi può essere ritardato durante le prime 1-2 settimane di trattamento rispetto ad altri farmaci antipsicotici che non richiedono una titolazione simile. I medici prescrittori devono tenere presente questo ritardo nella scelta di un farmaco antipsicotico per il trattamento della schizofrenia.
continua la storia qui sotto
Dosaggio e amministrazione
Dose abituale
FANAPT deve essere titolato lentamente da una dose iniziale bassa per evitare ipotensione ortostatica a causa delle sue proprietà di blocco alfa-adrenergico. La dose iniziale raccomandata per le compresse di FANAPT è di 1 mg per via orale due volte al giorno. Gli aumenti della dose per raggiungere l'intervallo target di 6-12 mg due volte al giorno (12-24 mg / giorno) possono essere effettuati con aggiustamenti della dose giornaliera non superiori a 2 mg due volte al giorno (4 mg / giorno). La dose massima raccomandata è di 12 mg due volte al giorno (24 mg / giorno). Dosi FANAPT superiori a 24 mg / die non sono state sistematicamente valutate negli studi clinici. L'efficacia è stata dimostrata con FANAPT in un intervallo di dosi da 6 a 12 mg due volte al giorno. I medici prescrittori devono essere consapevoli del fatto che i pazienti devono essere titolati a una dose efficace di FANAPT. Pertanto, il controllo dei sintomi può essere ritardato durante le prime 1-2 settimane di trattamento rispetto ad altri farmaci antipsicotici che non richiedono una titolazione simile. I medici prescrittori devono anche essere consapevoli del fatto che alcuni effetti avversi associati all'uso di FANAPT sono correlati alla dose. FANAPT può essere somministrato indipendentemente dai pasti.
Dosaggio in popolazioni speciali
Aggiustamento del dosaggio per i pazienti che assumono FANAPT in concomitanza con potenziali inibitori del CYP2D6: la dose di FANAPT deve essere ridotto della metà quando somministrato in concomitanza con potenti inibitori del CYP2D6 come fluoxetina o paroxetina. Quando l'inibitore del CYP2D6 viene ritirato dalla terapia di associazione, la dose di FANAPT deve essere aumentata fino a dove era prima.
Aggiustamento del dosaggio per i pazienti che assumono FANAPT in concomitanza con potenziali inibitori del CYP3A4: la dose di FANAPT deve essere ridotto della metà quando somministrato in concomitanza con potenti inibitori del CYP3A4 come il ketoconazolo o claritromicina. Quando l'inibitore del CYP3A4 viene ritirato dalla terapia di associazione, la dose di FANAPT deve essere aumentata fino a dove era prima.
Aggiustamento del dosaggio per i pazienti che assumono FANAPT che sono metabolizzatori lenti del CYP2D6: la dose di FANAPT deve essere ridotta della metà per i metabolizzatori lenti del CYP2D6.
Insufficienza epatica: nei pazienti con lieve insufficienza epatica non è necessario alcun aggiustamento della dose di FANAPT. I pazienti con insufficienza epatica moderata possono richiedere una riduzione della dose, se clinicamente indicato. FANAPT non è raccomandato per i pazienti con grave compromissione epatica.
Trattamento di mantenimento
In uno studio a più lungo termine, FANAPT si è dimostrato efficace nel ritardare il tempo di recidiva in pazienti con schizofrenia stabilizzati con FANAPT fino a 24 mg / die. I pazienti devono essere periodicamente rivalutati per determinare la necessità di un trattamento di mantenimento.
Reinizializzazione del trattamento nei pazienti precedentemente sospesi Sebbene non vi siano dati per affrontare in modo specifico la reinizializzazione trattamento, si raccomanda di seguire il programma di titolazione iniziale ogni volta che i pazienti hanno avuto un intervallo di FANAPT di più di 3 giorni.
superiore
Forme di dosaggio e punti di forza
Le compresse di FANAPT sono disponibili nei seguenti dosaggi: 1 mg, 2 mg, 4 mg, 6 mg, 8 mg, 10 mg e 12 mg. Le compresse sono bianche, rotonde, piatte, con bordi smussati e identificate con un logo "" impresso su un lato e forza della compressa "1", "2", "4", "6", "8", "10", o "12" inciso sull'altro lato.
superiore
Controindicazioni
FANAPT è controindicato nei soggetti con una nota reazione di ipersensibilità al prodotto. Sono stati segnalati anafilassi, angioedema e altre reazioni di ipersensibilità.
superiore
AVVERTENZE E PRECAUZIONI
Aumento della mortalità nei pazienti anziani con psicosi correlata alla demenza
I farmaci antipsicotici aumentano il rischio di morte per tutte le cause nei pazienti anziani con psicosi correlata alla demenza. Analisi di 17 studi clinici controllati verso placebo con psicosi da demenza (durata modale di 10 settimane e in gran parte in pazienti che assumono atipici farmaci antipsicotici) ha rivelato un rischio di morte nei pazienti trattati con farmaci tra 1,6 e 1,7 volte rispetto ai pazienti trattati con placebo. Nel corso di un tipico studio controllato di 10 settimane, il tasso di morte nei pazienti trattati con farmaci è stato di circa il 4,5%, rispetto a un tasso di circa il 2,6% nei pazienti trattati con placebo.
Sebbene le cause della morte fossero varie, la maggior parte delle morti sembra essere di natura cardiovascolare (ad es. Insufficienza cardiaca, morte improvvisa) o infettiva (ad es. Polmonite). FANAPT non è approvato per il trattamento di pazienti con psicosi correlata alla demenza.
Reazioni avverse cerebrovascolari, incluso ictus, in pazienti anziani con psicosi correlata alla demenza
In studi controllati con placebo su soggetti anziani con demenza, pazienti randomizzati a risperidone, aripiprazolo e olanzapina hanno avuto una maggiore incidenza di ictus e attacco ischemico transitorio, incluso fatale ictus. FANAPT non è approvato per il trattamento di pazienti con psicosi correlata alla demenza.
Prolungamento QT
In uno studio QTc in aperto su pazienti con schizofrenia o disturbo schizoaffettivo (n = 160), FANAPT è stato associato a un prolungamento dell'intervallo QT di 9 msec a una dose di iloperidone di 12 mg due volte al giorno. L'effetto di FANAPT sull'intervallo QT è stato aumentato dalla presenza di inibizione metabolica del CYP450 2D6 o 3A4 (rispettivamente paroxetina 20 mg una volta al giorno e ketoconazolo 200 mg due volte al giorno). In condizioni di inibizione metabolica sia per 2D6 che per 3A4, FANAPT 12 mg due volte al giorno è stato associato ad un aumento medio del QTcF dal basale di circa 19 msec.
Durante il programma clinico pre-marketing non sono stati osservati casi di torsione di punta o altre aritmie cardiache gravi.
L'uso di FANAPT deve essere evitato in combinazione con altri farmaci che sono noti per prolungare il QTc inclusa la Classe 1A (ad esempio, chinidina, procainamide) o farmaci antiaritmici di classe III (ad es. amiodarone, sotalolo), farmaci antipsicotici (ad es. clorpromazina, tioridazina), antibiotici (ad es. gatifloxacina, moxifloxacina) o qualsiasi altra classe di farmaci noti per prolungare l'intervallo QTc (ad es. pentamidina, levometadil acetato, metadone). FANAPT deve anche essere evitato in pazienti con sindrome del QT lungo congenito e in pazienti con anamnesi di aritmie cardiache.
Alcune circostanze possono aumentare il rischio di torsione di punta e / o morte improvvisa in associazione con l'uso di farmaci che prolungano l'intervallo QTc, tra cui (1) bradicardia; (2) ipopotassiemia o ipomagnesemia; (3) uso concomitante di altri farmaci che prolungano l'intervallo QTc; e (4) presenza di prolungamento congenito dell'intervallo QT; (5) recente infarto miocardico acuto; e / o (6) insufficienza cardiaca non compensata.
Si richiede cautela quando si prescrivono FANAPT con farmaci che inibiscono il metabolismo di FANAPT e in pazienti con ridotta attività di CYP2D6.
Si raccomanda ai pazienti di essere considerati per il trattamento con FANAPT a rischio significativo i disturbi elettrolitici hanno misurazioni al basale di potassio sierico e magnesio con periodiche misurazioni monitoraggio. Ipopotassiemia (e / o ipomagnesemia) può aumentare il rischio di prolungamento dell'intervallo QT e aritmia. FANAPT dovrebbe essere evitato in pazienti con storie di malattie cardiovascolari significative, ad es. QT prolungamento, recente infarto miocardico acuto, insufficienza cardiaca non compensata o aritmia cardiaca. FANAPT deve essere sospeso nei pazienti che risultano avere misurazioni QTc persistenti> 500 msec.
Se i pazienti che assumono FANAPT presentano sintomi che potrebbero indicare l'insorgenza di aritmie cardiache, ad es. vertigini, palpitazioni o sincope, il medico prescrittore dovrebbe iniziare un'ulteriore valutazione, incluso quella cardiaca monitoraggio.
Sindrome neurolettica maligna (NMS)
Un complesso di sintomi potenzialmente fatali a volte indicato come Sindrome neurolettica maligna (SNM) è stato riportato in associazione con la somministrazione di farmaci antipsicotici, incluso FANAPT. Le manifestazioni cliniche includono iperpiressia, rigidità muscolare, stato mentale alterato (inclusi segni catatonici) e evidenza di instabilità autonomica (polso irregolare o pressione sanguigna, tachicardia, diaforesi e cardiaca aritmia). Ulteriori segni possono includere elevata creatina fosfochinasi, mioglobinuria (rabdomiolisi) e insufficienza renale acuta. La valutazione diagnostica dei pazienti con questa sindrome è complicata. Nell'arrivare a una diagnosi, è importante identificare i casi in cui include la presentazione clinica sia gravi patologie mediche che segni e sintomi extrapiramidali non trattati o inadeguatamente trattati (EPS). Altre considerazioni importanti nella diagnosi differenziale includono tossicità anticolinergica centrale, colpo di calore, febbre da farmaco e patologia del sistema nervoso centrale primario (SNC).
La gestione di questa sindrome dovrebbe includere: (1) l'interruzione immediata dei farmaci antipsicotici e altri farmaci non essenziali per la terapia concomitante, (2) trattamento sintomatico intensivo e monitoraggio medico e (3) trattamento di eventuali problemi medici concomitanti gravi per i quali sono disponibili trattamenti specifici. Non esiste un accordo generale su regimi specifici di trattamento farmacologico per NMS.
Se un paziente richiede un trattamento farmacologico antipsicotico dopo il recupero dall'NMS, la potenziale reintroduzione della terapia farmacologica deve essere attentamente valutata. Il paziente deve essere attentamente monitorato, poiché sono state segnalate recidive di NMS.
Discinesia tardiva
La discinesia tardiva è una sindrome costituita da movimenti potenzialmente irreversibili, involontari e discinetici, che possono svilupparsi in pazienti trattati con farmaci antipsicotici. Sebbene la prevalenza della sindrome sembri essere più alta tra gli anziani, in particolare le donne anziane, è impossibile si basano su stime di prevalenza per prevedere, all'inizio del trattamento antipsicotico, quali pazienti sono suscettibili di sviluppare il sindrome. Non è noto se i farmaci antipsicotici differiscano nel loro potenziale di causare discinesia tardiva.
Si ritiene il rischio di sviluppare discinesia tardiva e la probabilità che diventerà irreversibile aumentare con la durata del trattamento e la dose cumulativa totale di antipsicotici somministrati aumenta. Tuttavia, la sindrome può svilupparsi, anche se molto meno comunemente, dopo periodi di trattamento relativamente brevi a basse dosi.
Non esiste un trattamento noto per i casi accertati di discinesia tardiva, sebbene la sindrome possa rimediare, parzialmente o completamente, se il trattamento antipsicotico viene interrotto. Lo stesso trattamento antipsicotico, tuttavia, può sopprimere (o sopprimere parzialmente) i segni e i sintomi della sindrome e quindi eventualmente mascherare il processo sottostante. L'effetto che la soppressione sintomatica ha sul decorso a lungo termine della sindrome non è noto.
Alla luce di queste considerazioni, FANAPT deve essere prescritto in modo tale da ridurre al minimo l'insorgenza di discinesia tardiva. Il trattamento antipsicotico cronico dovrebbe generalmente essere riservato ai pazienti che soffrono di una malattia cronica a cui (1) è noto rispondere farmaci antipsicotici e (2) per i quali non sono disponibili trattamenti alternativi, ugualmente efficaci, ma potenzialmente meno dannosi o adeguata. Nei pazienti che richiedono un trattamento cronico, deve essere ricercata la dose minima e la durata più breve del trattamento che producono una risposta clinica soddisfacente. La necessità di continuare il trattamento deve essere rivalutata periodicamente.
Se segni e sintomi di discinesia tardiva compaiono in un paziente con FANAPT, deve essere presa in considerazione l'interruzione del farmaco. Tuttavia, alcuni pazienti possono richiedere un trattamento con FANAPT nonostante la presenza della sindrome.
Cambiamenti metabolici
I farmaci antipsicotici atipici sono stati associati a cambiamenti metabolici che possono aumentare il rischio cardiovascolare / cerebrovascolare. Questi cambiamenti metabolici includono iperglicemia, dislipidemia e aumento di peso corporeo. Mentre è stato dimostrato che tutti i farmaci antipsicotici atipici producono alcuni cambiamenti metabolici, ogni farmaco della classe ha il suo profilo di rischio specifico.
Iperglicemia e diabete mellito
L'iperglicemia, in alcuni casi estrema e associata a chetoacidosi, coma iperosmolare o morte, è stata segnalata in pazienti trattati con antipsicotici atipici, incluso FANAPT. La valutazione della relazione tra uso atipico di antipsicotici e anomalie del glucosio è complicata dalla possibilità di un aumento rischio di fondo di diabete mellito in pazienti con schizofrenia e la crescente incidenza del diabete mellito in generale popolazione. Dati questi fattori di confondimento, la relazione tra l'uso di antipsicotici atipici e gli eventi avversi correlati all'iperglicemia non è completamente compresa. Tuttavia, studi epidemiologici suggeriscono un aumento del rischio di eventi avversi correlati all'iperglicemia in pazienti trattati con antipsicotici atipici inclusi in questi studi.
I pazienti con una diagnosi accertata di diabete mellito che iniziano con antipsicotici atipici devono essere monitorati regolarmente per peggiorare il controllo del glucosio. Pazienti con fattori di rischio per il diabete mellito (ad es. Obesità, storia familiare di diabete) che iniziano il trattamento gli antipsicotici atipici devono essere sottoposti a test della glicemia a digiuno all'inizio del trattamento e periodicamente durante trattamento. Qualsiasi paziente trattato con antipsicotici atipici deve essere monitorato per i sintomi di iperglicemia tra cui polidipsia, poliuria, polifagia e debolezza. I pazienti che sviluppano sintomi di iperglicemia durante il trattamento con antipsicotici atipici devono sottoporsi a test della glicemia a digiuno. In alcuni casi, l'iperglicemia si è risolta quando è stato sospeso l'antipsicotico atipico; tuttavia, alcuni pazienti hanno richiesto la continuazione del trattamento antidiabetico nonostante l'interruzione del farmaco sospetto.
I dati di uno studio di 4 settimane a dose fissa su soggetti adulti affetti da schizofrenia, in cui sono stati prelevati campioni di sangue a digiuno, sono presentati nella Tabella 1.

Le analisi congiunte dei dati sul glucosio provenienti da studi clinici, inclusi studi a lungo termine, sono mostrati nella Tabella 2.
dislipidemia
Alterazioni indesiderate dei lipidi sono state osservate in pazienti trattati con antipsicotici atipici.
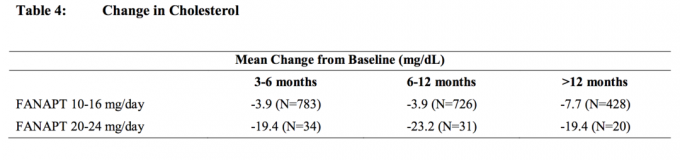
I dati di uno studio di 4 settimane a dose fissa, controllato con placebo, in cui sono stati prelevati campioni di sangue a digiuno, in soggetti adulti con schizofrenia sono presentati nella Tabella 3.

Le analisi congiunte dei dati di colesterolo e trigliceridi da studi clinici, inclusi studi a lungo termine, sono mostrate nella Tabella 4 e nella Tabella 5.

Aumento di peso
L'aumento di peso è stato osservato con l'uso di antipsicotici atipici. Si raccomanda il monitoraggio clinico del peso.
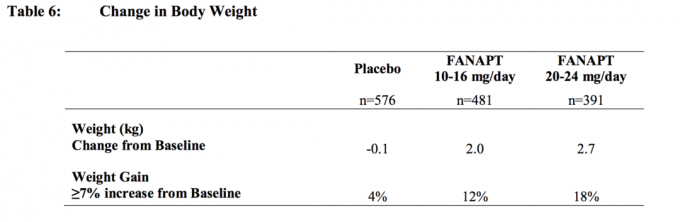
In tutti gli studi a breve e lungo termine, la variazione media complessiva dal basale all'endpoint è stata di 2,1 kg.
Cambiamenti nel peso corporeo (kg) e nella proporzione di soggetti con un aumento ≥7% del peso corporeo da 4 Sono presentati studi controllati con placebo, a 4 o 6 settimane, a dose fissa o flessibile in soggetti adulti Tabella 6
Convulsioni
Negli studi a breve termine controllati con placebo (da 4 a 6 settimane), si sono verificate convulsioni nello 0,1% (1/1344) dei pazienti trattati con FANAPT rispetto allo 0,3% (2/587) con placebo. Come con altri antipsicotici, FANAPT deve essere usato con cautela in pazienti con anamnesi di convulsioni o con condizioni che potrebbero abbassare la soglia convulsiva. Le condizioni che abbassano la soglia convulsiva possono essere più frequenti in una popolazione di 65 anni o più.
Ipotensione e sincope ortostatica
FANAPT può indurre ipotensione ortostatica associata a vertigini, tachicardia e sincope. Ciò riflette le sue proprietà antagoniste alfa1-adrenergiche. In studi a breve termine in doppio cieco controllati con placebo, in cui la dose è stata aumentata lentamente, come raccomandato sopra, la sincope è stata riportata nello 0,4% (5/1344) dei pazienti trattati con FANAPT, rispetto allo 0,2% (1/587) su placebo. Ipotensione ortostatica è stata segnalata nel 5% dei pazienti trattati con 20-24 mg / die, nel 3% dei pazienti trattati con 10-16 mg / die e nell'1% dei pazienti trattati con placebo. Una titolazione più rapida dovrebbe aumentare il tasso di ipotensione ortostatica e sincope.
FANAPT deve essere usato con cautela nei pazienti con malattie cardiovascolari note (ad es. Insufficienza cardiaca, anamnesi di infarto miocardico, ischemia o conduzione anomalie), malattia cerebrovascolare o condizioni che predispongono il paziente all'ipotensione (disidratazione, ipovolemia e trattamento con antiipertensivi farmaci). Il monitoraggio dei segni vitali ortostatici deve essere considerato nei pazienti che sono vulnerabili all'ipotensione.
Leucopenia, neutropenia e agranulocitosi
Nella sperimentazione clinica e nell'esperienza post-marketing, sono stati riportati eventi temporali di leucopenia / neutropenia correlati agli agenti antipsicotici. È stata anche segnalata agranulocitosi (compresi casi fatali).
I possibili fattori di rischio per leucopenia / neutropenia comprendono la conta preesistente di globuli bianchi bassi (WBC) e la storia di leucopenia / neutropenia indotta da farmaci. I pazienti con un preesistente WBC basso o con una storia di leucopenia / neutropenia indotta da farmaci devono essere sottoposti a monitoraggio completo del loro emocromo frequentemente durante i primi mesi di terapia e dovrebbe interrompere FANAPT al primo segno di un declino del globulo bianco in assenza di altre cause fattori.
I pazienti con neutropenia devono essere attentamente monitorati per la febbre o altri sintomi o segni di infezione e trattati prontamente se si verificano tali sintomi o segni. I pazienti con neutropenia grave (conta assoluta dei neutrofili <1000 / mm3) devono interrompere FANAPT e far seguire il loro WBC fino al recupero.
iperprolattinemia
Come con altri farmaci che antagonizzano i recettori della dopamina D2, FANAPT aumenta i livelli di prolattina.
L'iperprolattinemia può sopprimere il GnRH ipotalamico, con conseguente riduzione della secrezione di gonadotropina ipofisaria. Questo, a sua volta, può inibire la funzione riproduttiva compromettendo la gonadalsteroidogenesi in pazienti sia di sesso femminile che maschile. Galattorrea, amenorrea, ginecomastia e impotenza sono stati segnalati con composti che aumentano la prolattina. Iperprolattinemia di lunga durata se associata a ipogonadismo può portare a una riduzione della densità ossea in pazienti sia di sesso femminile che maschile.
Gli esperimenti di coltura tissutale indicano che circa un terzo dei tumori al seno umani sono prolattina-dipendenti in vitro, a fattore di potenziale importanza se la prescrizione di questi farmaci è contemplata in un paziente con seno precedentemente rilevato cancro. Sono stati osservati cambiamenti proliferativi della ghiandola mammaria e aumenti della prolattina sierica nei topi e nei ratti trattati con FANAPT. Né studi clinici né studi epidemiologici condotti finora hanno mostrato un'associazione tra la somministrazione cronica di questa classe di farmaci e la tumorigenesi nell'uomo; le prove disponibili sono considerate troppo limitate per essere conclusive in questo momento.
In uno studio a breve termine controllato con placebo (4 settimane), la variazione media dal basale all'endpoint nei livelli plasmatici di prolattina per il gruppo trattato con FANAPT 24 mg / die è stato un aumento di 2,6 ng / mL rispetto a una diminuzione di 6,3 ng / mL nel gruppo placebo. In questo studio, sono stati osservati livelli elevati di prolattina plasmatica nel 26% degli adulti trattati con FANAPT rispetto al 12% nel gruppo placebo. Negli studi a breve termine, FANAPT è stato associato a livelli modesti di aumento della prolattina rispetto ai maggiori aumenti di prolattina osservati con alcuni altri agenti antipsicotici. Nell'analisi aggregata di studi clinici, inclusi studi a lungo termine, in 3210 adulti trattati con iloperidone, la ginecomastia è stata riportata in 2 soggetti maschi (0,1%) rispetto allo 0% nei pazienti trattati con placebo e la galattorrea è stata riportata in 8 soggetti di sesso femminile (0,2%) rispetto a 3 soggetti di sesso femminile (0,5%) in pazienti trattati con placebo pazienti.
Regolazione della temperatura corporea
L'interruzione della capacità del corpo di ridurre la temperatura corporea è stata attribuita agli agenti antipsicotici. Si consiglia la cura appropriata quando si prescrive FANAPT per i pazienti che sperimenteranno condizioni che possono contribuire ad un aumento del corpo centrale temperatura, ad es. esercizio fisico intenso, esposizione a calore estremo, ricevimento di farmaci concomitanti con attività anticolinergica o essere soggetto a disidratazione.
Disfagia
Dismotilità e aspirazione esofagee sono state associate all'uso di farmaci antipsicotici. La polmonite da aspirazione è una causa comune di morbilità e mortalità nei pazienti anziani. FANAPT e altri farmaci antipsicotici devono essere usati con cautela nei pazienti a rischio di polmonite da aspirazione.
Suicidio
La possibilità di un tentativo di suicidio è inerente alla malattia psicotica e una stretta supervisione dei pazienti ad alto rischio dovrebbe accompagnare la terapia farmacologica. Le prescrizioni per FANAPT devono essere scritte per la più piccola quantità di compresse coerenti con una buona gestione del paziente al fine di ridurre il rischio di sovradosaggio.
priapismo
Tre casi di priapismo sono stati segnalati nel programma FANAPT pre-marketing. È stato riportato che i farmaci con effetti di blocco alfa-adrenergico inducono priapismo. FANAPT condivide questa attività farmacologica. Il priapismo grave può richiedere un intervento chirurgico.
Potenziale per danni cognitivi e motori
FANAPT, come altri antipsicotici, ha il potenziale per compromettere il giudizio, il pensiero o le capacità motorie. Negli studi a breve termine controllati con placebo, è stata segnalata sonnolenza (compresa la sedazione) nell'11,9% (104/874) di pazienti adulti trattati con FANAPT a dosi di 10 mg / die o superiori rispetto al 5,3% (31/587) trattati con placebo. I pazienti devono essere avvertiti dell'utilizzo di macchinari pericolosi, comprese le automobili, fino a quando non sono ragionevolmente certi che la terapia con FANAPT non li influenzi negativamente.
superiore
Reazioni avverse
Esperienza di studi clinici
Poiché gli studi clinici sono condotti in condizioni ampiamente variabili, i tassi di reazioni avverse osservati nello studio clinico di un farmaco non può essere direttamente confrontato con i tassi negli studi clinici di un altro farmaco e potrebbe non riflettere i tassi osservati negli studi clinici pratica. Le informazioni seguenti sono derivate da un database di studi clinici per FANAPT composto da 3229 pazienti esposti a FANAPT a dosi di 10 mg / giorno o superiori, per il trattamento della schizofrenia. Di questi, 999 hanno ricevuto FANAPT per almeno 6 mesi, con 657 esposti a FANAPT per almeno 12 mesi. Tutti questi pazienti che hanno ricevuto FANAPT stavano partecipando a studi clinici a dosi multiple. Le condizioni e la durata del trattamento con FANAPT variavano notevolmente e includevano (in categorie sovrapposte), in aperto e fasi in doppio cieco di studi, pazienti ricoverati e ambulatoriali, studi a dose fissa e dose flessibile e studi a breve e lungo termine esposizione.
Le informazioni presentate in queste sezioni sono state derivate da dati aggregati provenienti da 4 settimane controllate da placebo, da 4 a 6 settimane, studi a dose fissa o flessibile in pazienti che hanno ricevuto FANAPT a dosi giornaliere in un intervallo da 10 a 24 mg (N = 874).
Reazioni avverse che si verificano con un'incidenza del 2% o più tra i pazienti trattati con FANAPT e più frequenti del placebo
La tabella 7 elenca le incidenze aggregate di reazioni avverse che sono state segnalate spontaneamente in quattro settimane controllate da placebo, 4 o 6 settimane, studi a dose fissa o flessibile, che elencano quelle reazioni che si sono verificate nel 2% o più dei pazienti trattati con FANAPT in una qualsiasi delle dosi gruppi e per i quali l'incidenza nei pazienti trattati con FANAPT in qualsiasi gruppo di dosaggio è stata maggiore dell'incidenza nei pazienti trattati con placebo.

Reazioni avverse correlate alla dose in studi clinici
Sulla base dei dati aggregati di 4 studi controllati con placebo, di 4 o 6 settimane, a dose fissa o flessibile, reazioni avverse verificatesi con una percentuale superiore al 2% incidenza nei pazienti trattati con FANAPT e per i quali l'incidenza nei pazienti trattati con FANAPT 20-24 mg / die è stata doppia rispetto all'incidenza in i pazienti trattati con FANAPT 10-16 mg / die sono stati: fastidio addominale, vertigini, ipotensione, rigidità muscoloscheletrica, tachicardia e peso è aumentato.
Reazioni avverse comuni e correlate alla droga in studi clinici
Sulla base dei dati aggregati di 4 studi controllati con placebo, a 4 o 6 settimane, a dose fissa o flessibile, si sono verificate le seguenti reazioni avverse con un'incidenza ≥5% nei pazienti trattati con FANAPT e almeno due volte il placebo e per almeno 1 dose: vertigini, secchezza delle fauci, affaticamento, congestione nasale, sonnolenza, tachicardia, ipotensione ortostatica e peso è aumentato. Vertigini, tachicardia e aumento di peso erano almeno due volte più comuni con 20-24 mg / die rispetto a 10-16 mg / die.
Sintomi extrapiramidali (EPS) in studi clinici
I dati aggregati dei 4 studi controllati con placebo, a 4 o 6 settimane, a dose fissa o flessibile hanno fornito informazioni sull'EPS. I dati sugli eventi avversi raccolti da tali studi hanno mostrato le seguenti percentuali di eventi avversi correlati all'EPS, come mostrato nella Tabella 8.

Reazioni avverse associate all'interruzione del trattamento in studi clinici
Sulla base dei dati aggregati di 4 studi controllati con placebo, a 4 o 6 settimane, a dose fissa o flessibile, non è stato riscontrato differenza nell'incidenza della sospensione a causa di eventi avversi tra FANAPT (5%) e placebo (5%) pazienti. I tipi di eventi avversi che hanno portato alla sospensione sono stati simili per i pazienti trattati con FANAPT e placebo.
Differenze demografiche nelle reazioni avverse negli studi clinici
Un esame di sottogruppi di popolazione nei 4 controllati con placebo, 4- o 6 settimane, fissi o studi a dose flessibile non hanno rivelato alcuna evidenza di differenze nella sicurezza in base all'età, genere o razza.
Anomalie nei test di laboratorio negli studi clinici
Non ci sono state differenze tra FANAPT e placebo nell'incidenza della sospensione a causa di cambiamenti nell'ematologia, nelle analisi delle urine o nella chimica del siero.
Negli studi a breve termine controllati verso placebo (da 4 a 6 settimane), ci sono stati 1,0% (13/1342) pazienti trattati con iloperidone con ematocrito almeno una volta al di sotto dell'intervallo normale esteso durante il trattamento post-randomizzazione, rispetto allo 0,3% (2/585) su placebo. L'intervallo normale esteso per l'ematocrito abbassato è stato definito in ciascuno di questi studi come il valore del 15% al di sotto dell'intervallo normale per il laboratorio centralizzato utilizzato nello studio.
Altre reazioni durante la valutazione pre-marketing di FANAPT
Di seguito è riportato un elenco di termini MedDRA che riflettono le reazioni avverse nei pazienti trattati con FANAPT a dosi multiple ≥ 4 mg / die durante qualsiasi fase di una sperimentazione con il database di 3210 trattati con FANAPT pazienti. Sono incluse tutte le reazioni riportate ad eccezione di quelle già elencate nella Tabella 7 o di altre parti delle reazioni avverse (6), quelle considerate nella Avvertenze e precauzioni (5), quei termini di reazione che erano così generali da non essere informativi, reazioni riportate in meno di 3 pazienti e che non sono state né gravi né pericolose per la vita, reazioni che sono altrimenti comuni come reazioni di fondo e reazioni considerate improbabili come droga relazionato.
Le reazioni sono ulteriormente classificate in base alla classe di organi del sistema MedDRA ed elencate in ordine di frequenza decrescente secondo quanto segue definizioni: eventi avversi frequenti sono quelli che si verificano in almeno 1/100 pazienti (solo quelli non elencati nella Tabella 7 appaiono in questo messa in vendita); le reazioni avverse rare sono quelle che si verificano in pazienti da 1/100 a 1/1000; eventi rari sono quelli che si verificano in meno di 1/1000 pazienti.
Disturbi del sangue e dei linfatici: rara - anemia, anemia sideropenica; Rare-leucopenia
Disturbi cardiaci: frequente - palpitazioni; Raro: aritmia, blocco atrioventricolare di primo grado, insufficienza cardiaca (compresi congestione e acuta)
Patologie dell'orecchio e del labirinto: rara - vertigine, acufene
Disturbi endocrini: raro - ipotiroidismo
Patologie dell'occhio: frequente - congiuntivite (inclusa allergica); Raro - secchezza oculare, blefarite, edema palpebrale, gonfiore oculare, opacità lenticolari, cataratta, iperemia (inclusa congiuntivale)
Disturbi gastrointestinali: Raro - gastrite, ipersecrezione salivare, incontinenza fecale, ulcerazione della bocca; Raro - stomatite aftosa, ulcera duodenale, ernia iatale, ipercloridria, ulcerazione delle labbra, esofagite da reflusso, stomatite
Patologie sistemiche e condizioni relative alla sede di somministrazione: Raro - edema (generale, pitting, dovuto a cardiopatia), difficoltà a camminare, sete; Raro - ipertermia
Patologie epatobiliari: rara - colelitiasi
Esami diagnostici: frequente: calo ponderale; Raro: riduzione dell'emoglobina, aumento della conta dei neutrofili, riduzione dell'ematocrito
Disturbi del metabolismo e della nutrizione: poco frequente - aumento dell'appetito, disidratazione, ipopotassiemia, ritenzione idrica
Patologie del sistema muscoloscheletrico e del tessuto connettivo: frequente - mialgia, spasmi muscolari; Raro - torcicollo
Disturbi del sistema nervoso: rara parestesia, iperattività psicomotoria, irrequietezza, amnesia, nistagmo; Rara - sindrome delle gambe senza riposo
Disturbi psichiatrici: frequente - irrequietezza, aggressività, delirio; Raro - ostilità, diminuzione della libido, paranoia, anorgasmia, stato confusionale, mania, catatonia, sbalzi d'umore, panico attacco, disturbo ossessivo-compulsivo, bulimia nervosa, delirio, polidipsia psicogena, disturbo del controllo degli impulsi, maggiore depressione
Patologie renali e urinarie: frequente - incontinenza urinaria; Raro - disuria, pollakiuria, enuresi, nefrolitiasi; Raro - ritenzione urinaria, insufficienza renale acuta
Disturbi del sistema riproduttivo e del seno: frequente - disfunzione erettile; Poco frequente - dolore ai testicoli, amenorrea, dolore al seno; Raro - mestruazioni irregolari, ginecomastia, menorragia, metrorragia, emorragia postmenopausale, prostatite.
Patologie respiratorie, toraciche e mediastiniche: non frequente: epistassi, asma, rinorrea, congestione del seno, secchezza nasale; Raro - gola secca, sindrome dell'apnea notturna, dispnea da sforzo
Esperienza post-marketing
Le seguenti reazioni avverse sono state identificate durante l'uso post-approvazione di FANAPT: eiaculazione retrograda e reazioni di ipersensibilità (inclusa anafilassi; angioedema; senso di costrizione alla gola; gonfiore orofaringeo; gonfiore di viso, labbra, bocca e lingua; orticaria; eruzione cutanea; e prurito). Poiché queste reazioni sono state segnalate volontariamente da una popolazione di dimensioni incerte, non è possibile stimare in modo affidabile la loro frequenza o stabilire una relazione causale con l'esposizione al farmaco.
superiore
Interazioni farmacologiche
Dati gli effetti primari sul SNC di FANAPT, si deve usare cautela quando viene assunto in combinazione con altri farmaci ad azione centrale e alcool. Grazie al suo antagonismo del recettore alfa1-adrenergico, FANAPT ha il potenziale per migliorare l'effetto di alcuni agenti antiipertensivi.
Potenziale influenza di altri farmaci su FANAPT
L'ioperidone non è un substrato per gli enzimi CYP1A1, CYP1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C9, CYP2C19 o CYP2E1. Ciò suggerisce che è improbabile un'interazione di iloperidone con inibitori o induttori di questi enzimi o altri fattori, come il fumo. Sia il CYP3A4 che il CYP2D6 sono responsabili del metabolismo del iloperidone. Gli inibitori del CYP3A4 (ad es. Chetoconazolo) o del CYP2D6 (ad es. Fluoxetina, paroxetina) possono inibire l'eliminazione dell'iloperidone e causare un aumento dei livelli ematici.
Ketoconazolo: somministrazione concomitante di ketoconazolo (200 mg due volte al giorno per 4 giorni), un potente inibitore del CYP3A4, con una singola dose da 3 mg di iloperidone a 19 volontari sani, di età compresa tra 18 e 45 anni, hanno aumentato l'area sotto la curva (AUC) di iloperidone e dei suoi metaboliti P88 e P95 del 57%, 55% e 35%, rispettivamente. Le dosi di iloperidone devono essere ridotte di circa la metà quando somministrate con ketoconazolo o altri potenti inibitori del CYP3A4 (ad es. Itraconazolo). Non sono stati studiati inibitori più deboli (ad es. Eritromicina, succo di pompelmo). Quando l'inibitore del CYP3A4 viene ritirato dalla terapia di associazione, la dose di iloperidone deve essere riportata al livello precedente.
Fluoxetina: la somministrazione concomitante di fluoxetina (20 mg due volte al giorno per 21 giorni), un potente inibitore del CYP2D6, con una singola dose da 3 mg di iloperidone a 23 volontari sani, di età compresa tra 29 e 44 anni, che sono stati classificati come metabolizzatori estensivi del CYP2D6, hanno aumentato l'AUC del iloperidone e del suo metabolita P88, di circa 2-3 volte, e diminuito l'AUC del suo metabolita P95 di metà. Le dosi di iloperidone devono essere ridotte della metà quando somministrate con fluoxetina. Quando la fluoxetina viene sospesa dalla terapia di associazione, la dose di iloperidone deve essere riportata al livello precedente. Altri potenti inibitori del CYP2D6 dovrebbero avere effetti simili e richiederebbero riduzioni della dose appropriate. Quando l'inibitore del CYP2D6 viene ritirato dalla terapia di associazione, la dose di iloperidone potrebbe essere aumentata al livello precedente.
Paroxetina: somministrazione concomitante di paroxetina (20 mg / die per 5-8 giorni), un potente inibitore del CYP2D6, con dosi multiple di iloperidone (8 o 12 mg due volte al giorno) a pazienti con schizofrenia di età compresa tra 18 e 65 anni hanno determinato un aumento delle concentrazioni medie di picco allo stato stazionario di iloperidone e il suo metabolita P88, di circa 1,6 volte, e diminuito le concentrazioni di picco medie allo stato stazionario del suo metabolita P95 di metà. Le dosi di iloperidone devono essere ridotte della metà quando somministrate con paroxetina. Quando la paroxetina viene ritirata dalla terapia di associazione, la dose di iloperidone deve essere riportata al livello precedente. Altri potenti inibitori del CYP2D6 dovrebbero avere effetti simili e richiederebbero riduzioni della dose appropriate. Quando l'inibitore del CYP2D6 viene ritirato dalla terapia di associazione, la dose di iloperidone potrebbe essere aumentata ai livelli precedenti.
Paroxetina e ketoconazolo: somministrazione concomitante di paroxetina (20 mg una volta al giorno per 10 giorni), un inibitore del CYP2D6 e ketoconazolo (200 mg due volte al giorno) con dosi multiple di iloperidone (8 o 12 mg due volte al giorno) a pazienti con schizofrenia di età compresa tra 18 e 65 anni hanno portato a 1,4 aumento di piega delle concentrazioni allo stato stazionario di iloperidone e del suo metabolita P88 e diminuzione di 1,4 volte della P95 in presenza di paroxetina. Quindi somministrare iloperidone con inibitori di entrambe le sue vie metaboliche non ha aggiunto l'effetto di nessuno degli inibitori somministrato da solo. Le dosi di iloperidone devono pertanto essere ridotte di circa la metà se somministrate in concomitanza con un inibitore del CYP2D6 e del CYP3A4.
Potenziale influenza di FANAPT su altri farmaci
Studi in vitro su microsomi epatici umani hanno dimostrato che iloperidone non inibisce sostanzialmente il metabolismo di farmaci metabolizzati dai seguenti isozimi del citocromo P450: CYP1A1, CYP1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C9 o CYP2E1. Inoltre, studi in vitro su microsomi epatici umani hanno dimostrato che iloperidone non ha induttori enzimatici proprietà, in particolare per i seguenti isozimi del citocromo P450: CYP1A2, CYP2C8, CYP2C9, CYP2C19, CYP3A4 e CYP3A5.
Destrometorfano: uno studio condotto su volontari sani ha mostrato che i cambiamenti nella farmacocinetica del destrometorfano (dose da 80 mg) quando una dose da 3 mg di iloperidone è stato somministrato in concomitanza con un aumento del 17% dell'esposizione totale e un aumento del 26% delle concentrazioni plasmatiche massime C max di destrometorfano. Pertanto, è improbabile un'interazione tra iloperidone e altri substrati del CYP2D6.
Fluoxetina: una singola dose da 3 mg di iloperidone non ha avuto effetti sulla farmacocinetica della fluoxetina (20 mg due volte al giorno).
Midazolam (un substrato sensibile del CYP 3A4): uno studio su pazienti con schizofrenia ha mostrato un aumento di meno del 50% del totale di midazolam esposizione a iloperidone allo stato stazionario (14 giorni di somministrazione orale fino a 10 mg di iloperidone due volte al giorno) e nessun effetto sul midazolam C max. Pertanto, è improbabile un'interazione tra iloperidone e altri substrati del CYP3A4.
I farmaci che prolungano l'intervallo QT FANAPT non devono essere usati con altri farmaci che prolungano l'intervallo QT.
superiore
Utilizzare in popolazioni specifiche
Registro dell'esposizione alla gravidanza
Esiste un registro delle esposizioni alla gravidanza che monitora gli esiti della gravidanza nelle donne esposte a FANAPT durante la gravidanza. Per ulteriori informazioni, contattare il Registro nazionale delle gravidanze per gli antipsicotici atipici al numero 1-866-961-2388 o visitare http://womensmentalhealth.org/clinical-and -ricerca programmi / pregnancyregistry /.
Riepilogo dei rischi
I neonati le cui madri sono esposte a farmaci antipsicotici, incluso FANAPT, durante il terzo trimestre di gravidanza sono a rischio di sintomi extrapiramidali e / o di astinenza dopo il parto. I limitati dati disponibili con FANAPT in donne in gravidanza non sono sufficienti per informare il rischio associato al farmaco di gravi difetti alla nascita e aborto spontaneo. L'ioperidone non era teratogeno quando somministrato per via orale a ratti gravidi durante l'organogenesi a dosi fino a 26 volte la dose massima raccomandata nell'uomo di 24 mg / die su base mg / m2. Tuttavia, ha prolungato la durata della gravidanza e del parto, un aumento delle nascite ferme, decessi intrauterini precoci, un aumento dell'incidenza di ritardi nello sviluppo e una riduzione della sopravvivenza dei cuccioli dopo il parto. L'ioperidone non era teratogeno quando somministrato per via orale a conigli in gravidanza durante l'organogenesi a dosi fino a 20 volte la MRHD su base mg / m2. Tuttavia, ha aumentato i decessi intrauterini precoci e diminuito la vitalità fetale a termine alla massima dose, che era anche una dose tossica per la madre.
Il rischio di sfondo di gravi difetti alla nascita e aborto spontaneo per la popolazione indicata non è noto. Nella popolazione generale degli Stati Uniti, il rischio di fondo stimato di gravi difetti alla nascita e aborto spontaneo in gravidanze clinicamente riconosciute è rispettivamente del 2-4% e del 15-20%.
Considerazioni cliniche
Reazioni avverse fetali / neonatali
Sintomi extrapiramidali e / o di astinenza, tra cui agitazione, ipertonia, ipotonia, tremore, sonnolenza, difficoltà respiratoria e sono stati segnalati disturbi dell'alimentazione nei neonati le cui madri sono state esposte a farmaci antipsicotici durante il terzo trimestre di gravidanza. Questi sintomi hanno variato in gravità. Alcuni neonati si sono ripresi in poche ore o giorni senza un trattamento specifico; altri hanno richiesto un ricovero prolungato. Monitorare i neonati per i sintomi extrapiramidali e / o di astinenza e gestire i sintomi in modo appropriato.
Dati
Dati sugli animali
In uno studio sullo sviluppo embrio-fetale, ai ratti gravidi sono stati somministrati 4, 16 o 64 mg / kg / giorno (1,6, 6,5 e 26 volte la dose massima raccomandata nell'uomo (MRHD) di 24 mg / die su base mg / m2) di iloperidone per via orale durante il periodo di organogenesi. La dose più alta ha causato un aumento dei decessi intrauterini precoci, una riduzione del peso e della lunghezza del feto, diminuzione dell'ossificazione scheletrica fetale e aumento dell'incidenza di anomalie scheletriche fetali minori e variazioni; questa dose ha anche causato una riduzione del consumo di cibo materno e aumento di peso.
In uno studio sullo sviluppo embrio-fetale, ai conigli gravidi sono stati somministrati 4, 10 o 25 mg / kg / giorno (3, 8 e 20 volte l'MRHD su base mg / m2) di iloperidone durante il periodo di organogenesi. La dose più alta ha causato un aumento dei decessi intrauterini precoci e una riduzione della vitalità fetale a termine; questa dose ha anche causato tossicità materna.
In ulteriori studi in cui ai ratti è stato somministrato iloperidone a dosi simili a quelle precedenti a partire dal concepimento o da giorno 17 di gestazione e continuazione attraverso lo svezzamento, effetti collaterali sulla riproduzione inclusi gravidanza prolungata e parto, aumentato tassi di nati morti, aumento dell'incidenza delle variazioni viscerali fetali, riduzione del peso fetale e dei cuccioli e diminuzione dei cuccioli post-parto sopravvivenza. Non ci sono stati effetti farmacologici sullo sviluppo neurocomportamentale o riproduttivo dei cuccioli sopravvissuti. Le dosi senza effetto variavano da 4 a 12 mg / kg ad eccezione dell'aumento dei tassi di nati morti verificatisi alla dose minima testata di 4 mg / kg, che è 1,6 volte la MRHD su base mg / m2. In questi studi è stata osservata tossicità materna a dosi più elevate.
Il metabolita il95 di iloperidone P95, che è un importante metabolita circolante di iloperidone nell'uomo ma non è presente in quantità significative nei ratti sono state somministrate a ratti gravidi durante il periodo di organogenesi a dosi orali di 20, 80 o 200 mg kg / die. Non sono stati osservati effetti teratogeni. L'ossificazione scheletrica ritardata si è verificata a tutte le dosi. Non è stata prodotta alcuna tossicità materna significativa. I livelli plasmatici di P95 (AUC) alla massima dose testata sono stati 2 volte superiori a quelli nell'uomo trattati con MRHD di iloperidone.
lattazione
Riepilogo dei rischi
Non ci sono informazioni sulla presenza di iloperidone o dei suoi metaboliti nel latte materno, il effetti di iloperidone su un bambino allattato al seno, né effetti di iloperidone sul latte materno produzione. Iloperidone è presente nel latte di ratto. A causa del potenziale rischio di gravi reazioni avverse nei lattanti, avvisare una donna di non allattare durante il trattamento con FANAPT.
Dati Il trasferimento della radioattività nel latte dei ratti in allattamento è stato studiato dopo una singola dose di [14C] iloperidone a 5 mg / kg. La concentrazione di radioattività nel latte a 4 ore dopo la dose era quasi 10 volte maggiore di quella nel plasma contemporaneamente. Tuttavia, entro 24 ore dalla somministrazione, le concentrazioni di radioattività nel latte erano scese a valori leggermente inferiori rispetto al plasma. Il profilo metabolico nel latte era qualitativamente simile a quello nel plasma.
Uso pediatrico La sicurezza e l'efficacia nei pazienti pediatrici e adolescenti non sono state stabilite.
Uso geriatrico
Gli studi clinici di FANAPT nel trattamento della schizofrenia non hanno incluso un numero sufficiente di pazienti di età pari o superiore a 65 anni per determinare se rispondono in modo diverso rispetto agli adulti più giovani pazienti. Dei 3210 pazienti trattati con FANAPT negli studi di pre-marketing, 25 (0,5%) avevano un'età ≥65 anni e non c'erano pazienti di età ≥75 anni.
I pazienti anziani con psicosi correlata alla demenza trattati con FANAPT hanno un aumentato rischio di morte rispetto al placebo. FANAPT non è approvato per il trattamento di pazienti con psicosi correlata alla demenza.
Insufficienza renale
Poiché FANAPT è altamente metabolizzato, con meno dell'1% del farmaco escreto invariato, è improbabile che la sola insufficienza renale abbia un impatto significativo sulla farmacocinetica di FANAPT. La compromissione renale (clearance della creatinina <30 mL / min) ha avuto un effetto minimo sulla Cmax di iloperidone (somministrato in una singola dose di 3 mg) e sui suoi metaboliti P88 e P95 in uno qualsiasi dei 3analiti misurati. L'AUC0– ∞ è stato aumentato del 24%, diminuito del 6% e aumentato del 52% per iloperidone, P88 e P95, rispettivamente, nei soggetti con insufficienza renale.
Insufficienza epatica
Non è necessario alcun aggiustamento della dose di FANAPT in pazienti con compromissione epatica lieve. I pazienti con insufficienza epatica moderata possono richiedere una riduzione della dose. FANAPT non è raccomandato per i pazienti con grave compromissione epatica.
Nei soggetti adulti con lieve insufficienza epatica non è stata osservata alcuna differenza rilevante nella farmacocinetica di iloperidone, P88 o P95 (totale o non legato) rispetto ai controlli sani per adulti. Nei soggetti con insufficienza epatica moderata si è verificata un'esposizione libera maggiore (2 volte) e più variabile ai metaboliti attivi P88 osservato rispetto a controlli sani, mentre l'esposizione a iloperidone e P95 è stata generalmente simile (meno del 50% di variazione rispetto a controllo). Poiché non è stato condotto uno studio su soggetti con insufficienza epatica grave, FANAPT non è raccomandato per i pazienti con insufficienza epatica grave.
Stato del fumo
Sulla base di studi in vitro su enzimi epatici umani, FANAPT non è un substrato per CYP1A2; il fumo non dovrebbe pertanto avere effetti sulla farmacocinetica di FANAPT.
Gravidanza
superiore
Abuso e dipendenza da droghe
Sostanza controllata
FANAPT non è una sostanza controllata.
Abuso
FANAPT non è stato studiato sistematicamente negli animali o nell'uomo per il suo potenziale di abuso, tolleranza o dipendenza fisica. Mentre gli studi clinici non hanno rivelato alcuna tendenza al comportamento di ricerca di farmaci, queste osservazioni non erano sistematiche e non è possibile prevedere sulla base di questa esperienza la misura in cui un farmaco attivo sul SNC, FANAPT, verrà utilizzato in modo improprio, dirottato e / o abusato una volta commercializzato. Di conseguenza, i pazienti devono essere valutati attentamente per una storia di abuso di droghe e tali pazienti dovrebbero esserlo osservati attentamente per segni di uso improprio o abuso di FANAPT (ad es. sviluppo di tolleranza, aumento della dose, ricerca di droghe comportamento).
superiore
sovradosaggio
Esperienza umana
Negli studi pre-marketing che hanno coinvolto oltre 3210 pazienti, il sovradosaggio accidentale o intenzionale di FANAPT è stato documentato in 8 pazienti che vanno da 48 mg a 576 mg assunti contemporaneamente e 292 mg assunti nell'arco di 3 giorni periodo. Non sono stati segnalati incidenti mortali in questi casi. La più grande ingestione singola confermata di FANAPT è stata di 576 mg; non sono stati osservati effetti fisici avversi per questo paziente. La successiva più grande ingestione confermata di FANAPT è stata di 438 mg in un periodo di 4 giorni; sintomi extrapiramidali e un intervallo QTc di 507 msec sono stati riportati per questo paziente senza sequele cardiache. Questo paziente ha ripreso il trattamento con FANAPT per altri 11 mesi.
In generale, i segni e i sintomi riportati erano quelli risultanti da un'esagerazione degli effetti farmacologici noti (ad es. Sonnolenza e sedazione, tachicardia e ipotensione) di FANAPT.
Gestione del sovradosaggio
Non esiste un antidoto specifico per FANAPT. Pertanto, dovrebbero essere istituite adeguate misure di supporto. In caso di sovradosaggio acuto, il medico deve stabilire e mantenere una via aerea e garantire un'adeguata ossigenazione e ventilazione. Devono essere considerati lavanda gastrica (dopo intubazione, se il paziente è incosciente) e somministrazione di carbone attivo insieme a un lassativo. La possibilità di ottundimento, convulsioni o reazione distonica della testa e del collo a seguito di sovradosaggio può creare un rischio di aspirazione con emesi indotta. Il monitoraggio cardiovascolare dovrebbe iniziare immediatamente e dovrebbe includere un monitoraggio ECG continuo per rilevare possibili aritmie. Se viene somministrata una terapia antiaritmica, la disopiramide, la procainamide e la chinidina non devono essere utilizzate, poiché hanno il potenziale per effetti di prolungamento dell'intervallo QT che potrebbero essere additivi a quelli di FANAPT. Allo stesso modo, è ragionevole aspettarsi che le proprietà di alfa-blocco del bretlio possano essere additive a quelle di FANAPT, con conseguente ipotensione problematica. Ipotensione e collasso circolatorio devono essere trattati con misure appropriate come fluidi endovenosi o agenti simpaticomimetici (epinefrina e dopamina non devono essere utilizzate, poiché la stimolazione beta può peggiorare l'ipotensione nel contesto dell'alfa indotta da FANAPT blocco). In caso di gravi sintomi extrapiramidali, devono essere somministrati farmaci anticolinergici. Una stretta supervisione medica deve continuare fino a quando il paziente non si riprende.
superiore
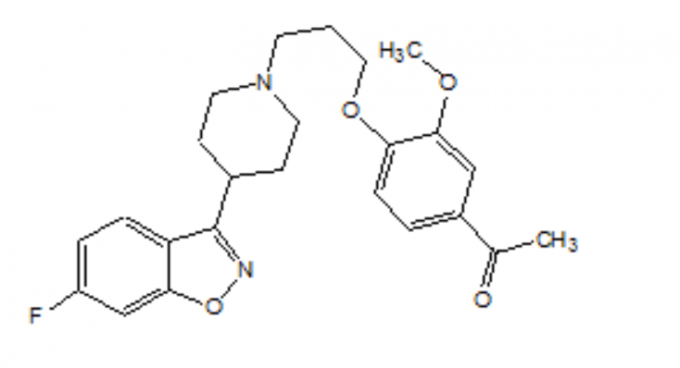
Descrizione
FANAPT è un antipsicotico atipico appartenente alla classe chimica dei derivati piperidinil-benzisoxazolo. Il suo nome chimico è 4 '- [3- [4- (6-Fluoro-1,2- benzisoxazol-3-il) piperidino] propossi] -3'-metossiacetofenone. La sua formula molecolare è C24H27FN2O4 e il suo peso molecolare è 426,48. La formula strutturale è:
Iloperidone è una polvere finemente cristallina da bianca a biancastra. È praticamente insolubile in acqua, leggermente solubile in HCl 0,1 N e liberamente solubile in cloroformio, etanolo, metanolo e acetonitrile.
Le compresse di FANAPT sono destinate esclusivamente alla somministrazione orale. Ogni round, non patinato
la compressa contiene 1 mg, 2 mg, 4 mg, 6 mg, 8 mg, 10 mg o 12 mg di iloperidone. Gli ingredienti inattivi sono: lattosio monoidrato, cellulosa microcristallina, idrossipropilmetilcellulosa, crospovidone, magnesio stearato, silicio colloidale
biossido e acqua purificata (rimossa durante la lavorazione). Le compresse sono bianche, rotonde, piatte, con bordi smussati e identificate con un logo "" impresso su un lato e forza della compressa "1", "2", "4", "6", "8", "10", o "12" inciso sull'altro lato.
superiore
Farmacologia clinica
Meccanismo di azione
Il meccanismo d'azione del iloperidone nella schizofrenia non è noto. Tuttavia, l'efficacia di iloperidone potrebbe essere mediata attraverso una combinazione di antagonismo della dopamina tipo 2 (D2) e serotonina tipo 2 (5-HT2).
L'ioperidone forma un metabolita attivo, P88, che ha un profilo di legame del recettore in vitro simile al farmaco originale.
farmacodinamica
L'ioperidone agisce come un antagonista con legame di affinità elevato (nM) alla serotonina 5-HT2A dopamina D2 e Recettori D3 e recettori NEα1 della noradrenalina (valori Ki di 5,6, 6,3, 7,1 e 0,36 nM, rispettivamente). Iloperidone ha una moderata affinità per i recettori della dopamina D4 e della serotonina 5-HT6 e 5 -HT7 (valori di Ki di 25, 43 e 22, nM rispettivamente) e bassa affinità per i recettori della serotonina 5-HT1A, dopamina D1 e istamina H1 (valori di Ki di 168, 216 e 437 nM, rispettivamente). Iloperidone non ha affinità apprezzabile (Ki> 1000 nM) per i recettori muscarinici colinergici. L'affinità del metabolita P88 dell'operidone è generalmente uguale o inferiore a quella del composto genitore, mentre solo il metabolita P95 mostra affinità per 5-HT2A (valore Ki di 3,91) e per i recettori NEα1A, NEα1B, NEα1D e NEα2C (valori Ki di 4.7, 2.7, 8.8 e 4.7 nM rispettivamente).
farmacocinetica
L'emivita di eliminazione media osservata per iloperidone, P88 e P95 nei metabolizzatori estensivi del CYP2D6 (EM) sono 18, 26 e 23 ore, rispettivamente, e in metabolizzatori poveri (PM) sono 33, 37 e 31 ore, rispettivamente. Le concentrazioni allo stato stazionario vengono raggiunte entro 3-4 giorni dalla somministrazione. L'accumulo di iloperidone è prevedibile dalla farmacocinetica a dose singola. La farmacocinetica di iloperidone è più che proporzionale alla dose. L'eliminazione dell'iloperidone avviene principalmente attraverso il metabolismo epatico che coinvolge 2 isozimi P450, CYP2D6 e CYP3A4.
Assorbimento: Iloperidone è ben assorbito dopo la somministrazione della compressa con concentrazioni plasmatiche di picco che si verificano entro 2-4 ore; mentre la biodisponibilità relativa della formulazione in compresse rispetto alla soluzione orale è del 96%. La somministrazione di iloperidone con un pasto ad alto contenuto di grassi standard non ha influenzato in modo significativo la Cmax o l'AUC di iloperidone, P88 o P95, ma ha ritardato Tmax di 1 ora per iloperidone, 2 ore per P88 e 6 ore per P95. FANAPT può essere somministrato indipendentemente dai pasti.
Distribuzione: l'Iloperidone ha una clearance apparente (clearance / biodisponibilità) da 47 a 102 L / h, con un volume apparente di distribuzione di 1340-2800 L. A concentrazioni terapeutiche, la frazione non legata di iloperidone nel plasma è ~ 3% e di ogni metabolita (P88 e P95) è ~ 8%.
Metabolismo ed eliminazione: Iloperidone è metabolizzato principalmente da 3 vie di biotrasformazione: riduzione carbonilica, idrossilazione (mediata dal CYP2D6) e O-demetilazione (mediata dal CYP3A4). Esistono 2 metaboliti iloperidone predominanti, P95 e P88. Il metabolita il95 di iloperidone P95 rappresenta il 47,9% dell'AUC di iloperidone e dei suoi metaboliti nel plasma allo stato stazionario per metabolizzatori estensivi (EM) e il 25% per metabolizzatori lenti (PM). Il metabolita attivo P88 rappresenta rispettivamente il 19,5% e il 34,0% dell'esposizione plasmatica totale in EM e PM.
Circa il 7% -10% dei caucasici e il 3% -8% degli afroamericani / neri non hanno la capacità di metabolizzare il CYP2D6 substrati e sono classificati come metabolizzatori lenti (PM), mentre gli altri sono intermedi, estesi o ultrarapidi metabolizzatori. La somministrazione concomitante di FANAPT con potenti inibitori noti del CYP2D6 come la fluoxetina determina un aumento di 2,3 volte aumento dell'esposizione plasmatica di iloperidone e quindi metà della dose di FANAPT dovrebbe essere somministrati.
Allo stesso modo, i PM del CYP2D6 hanno un'esposizione più elevata all'iloperidone rispetto agli EM e i PM devono ridurre la dose della metà. Sono disponibili test di laboratorio per identificare i PM del CYP2D6.
La maggior parte dei materiali radioattivi sono stati recuperati nelle urine (rispettivamente 58,2% e 45,1% in EM e PM), con feci che rappresentano il 19,9% (EM) al 22,1% (PM) della radioattività dosata.
Interazione del trasportatore: Iloperidone e P88 non sono substrati di P-gp e iloperidone è un debole inibitore della P-gp.
superiore
Tossicologia non clinica
Cancerogenesi, mutagenesi, alterazione della fertilità
Cancerogenesi: studi di carcinogenicità a vita sono stati condotti su topi CD-1 e ratti Sprague Dawley. Iloperidone è stato somministrato per via orale a dosi di 2,5, 5,0 e 10 mg / kg / die a topi CD-1 e 4, 8 e 16 mg / kg / die a Ratti Sprague Dawley (0,5, 1,0 e 2,0 volte e 1,6, 3,2 e 6,5 volte, rispettivamente, MRHD di 24 mg / giorno su un mg / m2 base). C'è stata un'aumentata incidenza di tumori maligni della ghiandola mammaria nei topi femmine trattati solo con la dose più bassa (2,5 mg / kg / giorno). Non ci sono stati aumenti correlati al trattamento della neoplasia nei ratti.
Il potenziale cancerogeno del metabolita iloperidone P95, che è un importante metabolita circolante del iloperidone nell'uomo ma non è presente in quantità significative nei topi o ratti, è stato valutato in uno studio di carcinogenicità a vita su ratti Wistar a dosi orali di 25, 75 e 200 mg / kg / die nei maschi e 50, 150 e 250 (ridotto da 400) mg / kg / die in femmine. Cambiamenti neoplastici correlati al farmaco si sono verificati nei maschi, nella ghiandola pituitaria (pars distalis adenoma) a tutte le dosi e nel pancreas (adenoma a cellule di isole) ad alte dosi. I livelli plasmatici di P95 (AUC) nei maschi alle dosi testate (25, 75 e 200 mg / kg / die) sono stati rispettivamente circa 0,4, 3 e 23 volte l'esposizione umana a P95 all'MRHD di iloperidone.
Mutagenesi: Iloperidone è risultato negativo nei test di Ames e nei test di micronucleo del fegato di ratto e midollo osseo in vivo. L'ioperidone ha indotto aberrazioni cromosomiche nelle cellule di ovaio di criceto cinese (CHO) in vitro a concentrazioni che hanno anche causato una certa citotossicità.
Il metabolita il95 di iloperidone P95 era negativo nel test di Ames, nel test di aberrazione cromosomica V79 e in un test di micronucleo del midollo osseo in topo in vivo.
Compromissione della fertilità: Iloperidone ha ridotto la fertilità a 12 e 36 mg / kg in uno studio in cui sono stati trattati ratti sia maschi che femmine. La dose senza effetto era di 4 mg / kg, che è 1,6 volte la MRHD di 24 mg / giorno su base mg / m2.
superiore
Studi clinici
L'efficacia di FANAPT nel trattamento della schizofrenia è stata supportata da 2 placebo e studi a breve termine (4 e 6 settimane) a controllo attivo e uno randomizzato a lungo termine controllato con placebo prova di recesso. Tutti gli studi hanno arruolato pazienti che soddisfacevano i criteri DSM-III / IV per la schizofrenia.
Tre strumenti sono stati usati per valutare segni e sintomi psichiatrici in questi studi. La scala della sindrome positiva e negativa (PANSS) e la scala di valutazione psichiatrica breve (BPRS) sono entrambi inventari multi-oggetto.
di psicopatologia generale di solito utilizzato per valutare gli effetti del trattamento farmacologico nella schizofrenia. La valutazione Clinical Global Impression (CGI) riflette l'impressione di un osservatore esperto, perfettamente a conoscenza delle manifestazioni della schizofrenia, circa lo stato clinico generale del paziente.
Uno studio di 6 settimane controllato con placebo (n = 706) ha coinvolto 2 intervalli di dose flessibile di FANAPT (12-16 mg / die o 20-24 mg / die) rispetto al placebo e un controllo attivo (risperidone). Per il gruppo 12-16 mg / giorno, il programma di titolazione di FANAPT era di 1 mg due volte al giorno nei giorni 1 e 2, 2 mg due volte al giorno nei giorni 3 e 4, 4 mg due volte al giorno nei giorni 5 e 6 e 6 mg due volte tutti i giorni il 7 ° giorno. Per il gruppo 20-24 mg / die, il programma di titolazione di FANAPT era di 1 mg due volte al giorno il giorno 1, 2 mg due volte al giorno il giorno 2, 4 mg due volte al giorno il giorno 3, 6 mg due volte al giorno i giorni 4 e 5, 8 mg due volte al giorno il giorno 6 e 10 mg due volte al giorno il giorno 7. L'endpoint primario era la variazione rispetto al basale del punteggio totale BPRS alla fine del trattamento (Giorno 42). Entrambi i range di dose di 12-16 mg / die e 20-24 mg / die di FANAPT erano superiori al placebo sul punteggio totale BPRS. Il farmaco antipsicotico a controllo attivo sembrava essere superiore a FANAPT in questo studio nei primi 2 settimane, una scoperta che potrebbe in parte essere spiegata dalla titolazione più rapida che era possibile per questo droga. Nei pazienti in questo studio che sono rimasti in trattamento per almeno 2 settimane, iloperidone sembra aver avuto un'efficacia paragonabile al controllo attivo.
Uno studio di 4 settimane controllato con placebo (n = 604) ha comportato una dose fissa di FANAPT (24 mg / die) rispetto al placebo e un controllo attivo (ziprasidone). Il programma di titolazione per questo studio era simile a quello per lo studio di 6 settimane. Questo studio ha comportato la titolazione di FANAPT a partire da 1 mg due volte al giorno il giorno 1 e aumentando a 2, 4, 6, 8, 10 e 12 mg due volte al giorno nei giorni 2, 3, 4, 5, 6 e 7. L'endpoint primario era il cambiamento rispetto al basale del punteggio totale PANSS alla fine del trattamento (Giorno 28). La dose FANAPT di 24 mg / die era superiore al placebo nel punteggio totale PANSS. FANAPT sembrava avere un'efficacia simile al farmaco di controllo attivo che necessitava anche di una lenta titolazione della dose target.
In uno studio a lungo termine, pazienti ambulatoriali adulti clinicamente stabili (n = 303) che soddisfano i criteri del DSM-IV per la schizofrenia che sono rimasti stabili dopo 12 settimane di il trattamento in aperto con dosi flessibili di FANAPT (8 mg / die - 24 mg / die somministrate in dosi due volte al giorno) è stato randomizzato al placebo o per continuare la loro attuale dose di FANAPT (8 mg / die - 24 mg / die somministrati in dosi due volte al giorno) per l'osservazione di possibili ricadute durante la recidiva in doppio cieco fase di prevenzione. La stabilizzazione durante la fase in aperto è stata definita come su una dose stabilita di FANAPT che è rimasta invariata a causa dell'efficacia nelle 4 settimane precedenti la randomizzazione, con punteggio di gravità CGI di ≤4 e punteggio totale PANSS ≤70, un punteggio di ≤4 su ciascuno dei seguenti elementi PANSS individuali (delusioni P1, disorganizzazione concettuale P2, Comportamento allucinatorio P3, sospettosità / persecuzione P6, ostilità P7 o non collaborazione G8) e nessun ricovero o aumento del livello di assistenza da trattare esacerbazioni. La recidiva o imminente recidiva durante la fase di prevenzione della ricaduta in doppio cieco è stata definita come una delle seguente: ricovero ospedaliero dovuto al peggioramento della schizofrenia, aumento (peggioramento) del punteggio totale PANSS ≥30%, CGI-
Punteggio di miglioramento ≥6, paziente con comportamento suicidario, omicida o aggressivo o necessità di altri farmaci antipsicotici.

Sulla base dell'analisi intermedia, un comitato indipendente di monitoraggio dei dati ha deciso che lo studio avrebbe dovuto essere interrotto presto a causa di prove di efficacia. Sulla base dei risultati dell'analisi intermedia, confermati dal set di dati dell'analisi finale, i pazienti trattati con FANAPT ha sperimentato un tempo statisticamente significativo più lungo di recidiva o imminente ricaduta rispetto ai pazienti che hanno ricevuto placebo. La Figura 1 mostra la percentuale cumulativa stimata di pazienti con ricaduta o recidiva imminente in base al set di dati finale.
superiore
Come fornito / Conservazione e gestione
Le compresse FANAPT sono bianche, rotonde e identificate con un logo impresso su un lato e la forza del tablet “1”, “2”, “4”, “6”, “8”, “10” o “12” impresso sull'altro lato. Le compresse sono fornite nei seguenti punti di forza e configurazioni pacchetto:

Conservazione
Conservare le compresse FANAPT a temperatura ambiente controllata, 25 ° C (77 ° F); escursioni consentite a 15 ° a 30 ° C (da 59 ° a 86 ° F) [Vedi temperatura ambiente controllata USP]. Proteggere le compresse FANAPT dall'esposizione alla luce e all'umidità.
INFORMAZIONI SULLA CONSULENZA DEL PAZIENTE
Si consiglia ai medici di discutere i seguenti problemi con i pazienti per i quali prescrivono FANAPT:
Prolungamento dell'intervallo QT
I pazienti devono essere informati di consultare immediatamente il proprio medico in caso di svenimento, perdita di conoscenza o palpitazioni cardiache. I pazienti devono essere avvisati di non assumere FANAPT con altri farmaci che causano un prolungamento dell'intervallo QT. I pazienti devono essere informati dei medici che stanno assumendo FANAPT prima di assumere qualsiasi nuovo farmaco.
Sindrome neurolettica maligna
I pazienti e gli operatori sanitari devono essere informati che a volte viene indicato un complesso di sintomi potenzialmente fatali a come NMS è stato riportato in associazione con la somministrazione di farmaci antipsicotici, incluso FANAPT. Segni e sintomi di NMS includono iperpiressia, rigidità muscolare, stato mentale alterato ed evidenza di autonomia
instabilità (polso irregolare o pressione sanguigna, tachicardia, diaforesi e aritmia cardiaca).
Cambiamenti metabolici
I pazienti devono essere consapevoli dei sintomi di iperglicemia (glicemia alta) e diabete mellito. Pazienti a cui è stato diagnosticato il diabete, quelli con fattori di rischio per il diabete o quelli che li sviluppano i sintomi durante il trattamento devono essere monitorati con la glicemia all'inizio e periodicamente durante trattamento. I pazienti devono essere informati che durante il trattamento con FANAPT si è verificato un aumento di peso. Si raccomanda il monitoraggio clinico del peso.
Ipotensione ortostatica
I pazienti devono essere informati del rischio di ipotensione ortostatica, in particolare al momento di iniziare il trattamento, riprendere il trattamento o aumentare la dose.
Interferenza con prestazioni cognitive e motorie
Poiché FANAPT può potenzialmente compromettere il giudizio, il pensiero o le capacità motorie, i pazienti devono essere avvertiti far funzionare macchinari pericolosi, comprese le automobili, fino a quando non saranno ragionevolmente certi che la terapia FANAPT non li influenzi negativamente.
Gravidanza
Informare i pazienti che l'uso di Fanapt nel terzo trimestre può causare sintomi extrapiramidali e / o di astinenza in un neonato. Consigliare ai pazienti di informare il proprio medico in caso di gravidanza nota o sospetta.
Registro delle gravidanze
Informare i pazienti che esiste un registro delle esposizioni alla gravidanza che monitora gli esiti della gravidanza nelle donne esposte a FANAPT durante la gravidanza
lattazione
Consigliare alle donne di non allattare durante il trattamento con FANAPT.
Farmaco Concomitante
I pazienti devono essere informati di informare i loro medici se stanno assumendo o stanno pianificando di prendere qualsiasi prescrizione o farmaci da banco, poiché esiste un potenziale di interazione.
alcool
I pazienti devono essere avvisati di evitare l'alcool durante l'assunzione di FANAPT.
Esposizione al calore e disidratazione
I pazienti devono essere informati delle cure appropriate per evitare il surriscaldamento e la disidratazione.
Distribuito da:
Vanda Pharmaceuticals Inc.
Washington, D.C. 20037 USA
Vanda e Fanapt® sono marchi registrati di Vanda Pharmaceuticals Inc. negli Stati Uniti e in altri paesi.
torna in cima
Fanapt (Iloperidone) Guida alla prescrizione (PDF)
Le informazioni contenute in questa monografia non intendono coprire tutti i possibili usi, indicazioni, precauzioni, interazioni farmacologiche o effetti avversi. Questa informazione è generalizzata e non è intesa come consulenza medica specifica. Se ha domande sui medicinali che sta assumendo o desidera ulteriori informazioni, consultare il medico, il farmacista o l'infermiere.
ultimo aggiornamento 13/07
torna a: Homepage di farmacologia dei farmaci psichiatrici



