Glyset per il trattamento del diabete
Marchio: Glyset
Nome generico: Miglitol
Contenuti:
Descrizione
Farmacologia clinica
Studi clinici
Indicazioni e utilizzo
Controindicazioni
Precauzioni
Reazioni avverse
sovradosaggio
Dosaggio e amministrazione
Come viene fornito
Glyset, miglitol, informazioni per il paziente (in inglese semplice)
Descrizione
Le compresse di GLYSET contengono miglitolo, un inibitore orale dell'alfa-glucosidasi per l'uso nella gestione del diabete mellito non insulino-dipendente (NIDDM). Il miglitolo è un derivato della desossiossiririmicina ed è chimicamente noto come 3,4,5-piperidinetriolo, 1- (2-idrossietil) -2- (idrossimetil) -, [2R- (2Î ±, 3β, 4Î ±, 5β)] -. È una polvere da bianca a giallo pallido con un peso molecolare di 207,2. Il miglitolo è solubile in acqua e ha un pKa di 5,9. La sua formula empirica è C8H17NO5 e la sua struttura chimica è la seguente:
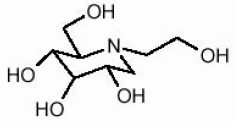
GLYSET è disponibile in compresse da 25 mg, 50 mg e 100 mg per uso orale. Gli ingredienti inattivi sono amido, cellulosa microcristallina, magnesio stearato, ipromellosa, polietilenglicole, biossido di titanio e polisorbato 80.
superiore
Farmacologia clinica
Il miglitolo è un derivato della desossiossiririmicina che ritarda la digestione dei carboidrati ingeriti, determinando così un minore aumento della concentrazione di glucosio nel sangue dopo i pasti. Come conseguenza della riduzione del glucosio plasmatico, le compresse GLYSET riducono i livelli di emoglobina glicosilata nei pazienti con diabete mellito di tipo II (non insulino-dipendente). La glicosilazione sistemica non enzimatica delle proteine, come riflesso dai livelli di emoglobina glicosilata, è una funzione della concentrazione media di glucosio nel sangue nel tempo.
Meccanismo di azione
Contrariamente alle sulfoniluree, GLYSET non migliora la secrezione di insulina. L'azione anti-iperglicemizzante del miglitolo deriva da un'inibizione reversibile degli enzimi β-glucoside idrolasi intestinale legati alla membrana. Le α-glucosidasi intestinali legate alla membrana idrolizzano oligosaccaridi e disaccaridi in glucosio e altri monosaccaridi nel margine del pennello dell'intestino tenue. Nei pazienti diabetici, questa inibizione enzimatica determina un ritardo nell'assorbimento del glucosio e una riduzione dell'iperglicemia postprandiale.
Poiché il suo meccanismo d'azione è diverso, l'effetto di GLYSET per migliorare il controllo glicemico è additivo a quello delle sulfoniluree quando usato in combinazione. Inoltre, GLYSET riduce gli effetti insulinotropici e di aumento del peso delle sulfoniluree.
Il miglitolo ha una minore attività inibitoria contro la lattasi e di conseguenza, alle dosi raccomandate, non ci si aspetta che induca intolleranza al lattosio.
farmacocinetica
Assorbimento
L'assorbimento del miglitolo è saturabile a dosi elevate: una dose di 25 mg è completamente assorbita, mentre una dose di 100 mg è assorbita solo dal 50% al 70%. Per tutte le dosi, le concentrazioni di picco vengono raggiunte in 2-3 ore. Non ci sono prove che l'assorbimento sistemico di miglitolo contribuisca al suo effetto terapeutico.
Distribuzione
Il legame con le proteine del miglitolo è trascurabile (<4,0%). Il miglitolo ha un volume di distribuzione di 0,18 L / kg, coerente con la distribuzione principalmente nel fluido extracellulare.
Metabolismo
Il miglitolo non è metabolizzato nell'uomo o in nessuna specie animale studiata. Non sono stati rilevati metaboliti nel plasma, nelle urine o nelle feci, indicando una mancanza di metabolismo sia sistemico che pre-sistemico.
Escrezione
Il miglitolo viene eliminato per escrezione renale come farmaco immodificato. Pertanto, dopo una dose da 25 mg, oltre il 95% della dose viene recuperato nelle urine entro 24 ore. A dosi più elevate, il recupero cumulativo del farmaco dalle urine è leggermente inferiore a causa della biodisponibilità incompleta. L'emivita di eliminazione del miglitolo dal plasma è di circa 2 ore.
Popolazioni speciali
Insufficienza renale
Poiché il miglitolo viene escreto principalmente dai reni, si prevede un accumulo di miglitolo nei pazienti con insufficienza renale. Pazienti con clearance della creatinina 60 ml / min. Non è possibile l'aggiustamento del dosaggio per correggere le concentrazioni plasmatiche aumentate perché il miglitolo agisce localmente. Sono disponibili poche informazioni sulla sicurezza del miglitolo in pazienti con clearance della creatinina <25 ml / min.
Insufficienza epatica
La farmacocinetica del miglitolo non è stata modificata nei pazienti cirrotici rispetto a soggetti di controllo sani. Poiché il miglitolo non è metabolizzato, non è prevista alcuna influenza della funzione epatica sulla cinetica del miglitolo.
Genere
Nessuna differenza significativa nella farmacocinetica del miglitolo è stata osservata tra uomini e donne anziani quando si è tenuto conto del peso corporeo.
Gara
Diversi studi di farmacocinetica sono stati condotti su volontari giapponesi, con risultati simili a quelli osservati nei caucasici. Uno studio che ha confrontato la risposta farmacodinamica a una singola dose da 50 mg in volontari sani neri e caucasici ha indicato risposte simili di glucosio e insulina in entrambe le popolazioni.
superiore
Studi clinici
Esperienza clinica in pazienti affetti da diabete mellito non insulino-dipendente (NIDDM) solo su trattamento dietetico
Le compresse di GLYSET sono state valutate in due studi in monoterapia a dose fissa, non controllati negli Stati Uniti e in tre, in cui 735 pazienti trattati con GLYSET sono stati valutati per analisi di efficacia (vedere Tabella 1).
Nello Studio 1, uno studio di un anno in cui GLYSET è stato valutato come monoterapia e anche come terapia di combinazione, si è verificato statisticamente aumento significativamente più piccolo dell'emoglobina glicosilata media (HbA1c) nel tempo nel braccio in monoterapia con miglitolo 50 mg 3 volte al giorno rispetto al placebo. Sono state osservate riduzioni significative nei livelli medi di glicemia a digiuno e postprandiale e nei livelli medi di insulina postprandiale nei pazienti trattati con GLYSET rispetto al gruppo placebo.
Nello Studio 2, uno studio di 14 settimane, si è verificata una riduzione significativa dell'HbA1c nei pazienti trattati con GLYSET 50 mg 3 volte al giorno o 100 mg 3 volte al giorno rispetto al placebo. Inoltre, ci sono state riduzioni significative dei livelli di glucosio plasmatico postprandiale e dei livelli sierici postprandiali di insulina rispetto al placebo.
Lo studio 3 è stato uno studio di 6 mesi con intervallo di dose che ha valutato GLYSET a dosi da 25 mg 3 volte al giorno a 200 mg 3 volte al giorno. GLYSET ha prodotto una riduzione maggiore dell'HbA1c rispetto al placebo a tutte le dosi, sebbene l'effetto sia stato statisticamente significativo solo alle dosi di 100 mg 3 volte al giorno e 200 mg 3 volte al giorno. Inoltre, tutte le dosi di GLYSET hanno prodotto riduzioni significative del glucosio plasmatico postprandiale e dei livelli di insulina postprandiale rispetto al placebo.
Gli studi 4 e 5 erano studi di 6 mesi che valutavano GLYSET a 50 e 100 mg 3 volte al giorno e 100 mg 3 volte al giorno, rispettivamente. Rispetto al placebo, GLYSET ha prodotto riduzioni significative dell'HbA1c, nonché una riduzione significativa della glicemia postprandiale in entrambi gli studi alle dosi impiegate.
Tabella 1 Risultati dello studio in monoterapia con Glyset
| Studia | Trattamento | HbA1c (%) | Glucosio postprandiale di 1 ora (mg / dL) | |
| Variazione media rispetto al basale * | Effetto del trattamento ** | Variazione media rispetto al basale | Effetto del trattamento ** | |
| 1 (Stati Uniti) | Placebo | +0.71 | +24 | |
| GLYSET 50 mg t.i.d. *** | +0.13 | -0.58†| -39 | -63†|
| 2 (Stati Uniti) | Placebo | +0.47 | +15 | |
| GLYSET 50 mg t.i.d. | -0.22 | -0.69†| -52 | -67†|
| GLYSET 100 mg t.i.d. | -0.28 | -0.75†| -59 | -74†|
| 3 (non USA) | Placebo | +0.18 | +2 | |
| GLYSET 25 mg t.i.d. | -0.08 | -0.26 | -33 | -35†|
| GLYSET 50 mg t.i.d. | -0.22 | -0.40 | -45 | -47†|
| GLYSET 100 mg t.i.d. | -0.63 | -0.81†| -62 | -64†|
| GLYSET 200 mg t.i.d.c | -0.84 | -1.02†| -85 | -87†|
| 4 (non statunitensi) | Placebo | +0.01 | +8 | |
| GLYSET 50 mg t.i.d. | -0.35 | -0.36†| -20 | -28†|
| GLYSET 100 mg t.i.d. | -0.57 | -0.58†| -25 | -33†|
| 5 (non statunitensi) | Placebo | +0.32 | +17 | |
| GLYSET 100 mg t.i.d. | -0.43 | -0.75†| -38 | -55†|
| * In questi studi il basale medio variava dal 7,54 all'8,72%. ** Il risultato della sottrazione della media del gruppo placebo. *** t.i.d. = 3 volte al giorno †p â ‰ ¤ 0,05 c Sebbene i risultati per 200 mg 3 volte al giorno siano presentati per completezza, il dosaggio massimo raccomandato di GLYSET è 100 mg 3 volte al giorno. |
Esperienza clinica in pazienti NIDDM che ricevono sulfoniluree
GLYSET è stato studiato come terapia aggiuntiva su uno sfondo di trattamento della sulfonilurea massima o quasi massima in tre grandi, studi randomizzati in doppio cieco (due U.S. e uno non U.S.) in cui 471 pazienti trattati con GLYSET sono stati valutati per l'efficacia (vedere Tavolo 2).
Lo studio 6 ha incluso pazienti in trattamento con dosi massime di SFU all'ingresso. Alla fine di questo studio di 14 settimane, gli effetti medi del trattamento sull'emoglobina glicosilata (HbA1c) erano -0,82% e -0,74% per i pazienti che ricevono GLYSET 50 mg 3 volte al giorno più SFU e GLYSET 100 mg 3 volte al giorno più SFU, rispettivamente.
Lo studio 7 era uno studio di un anno in cui GLYSET a 25, 50 o 100 mg 3 volte al giorno veniva aggiunto a una dose massima di gliburide (10 mg due volte al giorno). Alla fine di questo studio, gli effetti medi del trattamento su HbA1c di GLYSET quando vengono aggiunti al massimo gliburide la terapia era di -0,30%, -0,62% e -0,73% con i dosaggi di GLYSET da 25, 50 e 100 mg 3 volte al giorno, rispettivamente.
Nello Studio 8, l'aggiunta di GLYSET 100 mg 3 volte al giorno a uno sfondo di trattamento con gliburide ha prodotto un ulteriore effetto di trattamento medio su HbA1c di -0,66%.
Tabella 2: risultati della terapia combinata con GLYSET Plus Sulfonylurea (SFU)
| Studia | Trattamento | HbA1c (%) | Glucosio postprandiale di 1 ora (mg / dL) | |
| Variazione media rispetto al basale * | Effetto del trattamento ** | Variazione media rispetto al basale | Effetto del trattamento ** | |
| 6 (Stati Uniti) | Placebo + SFU | +0.33 | -1 | |
| GLYSET 50 mg t.i.d. *** + SFU | -0.49 | -0.82†| -69 | -68†|
| GLYSET 100 mg t.i.d. + SFU | -0.41 | -0.74†| -73 | -72†|
| 7 (Stati Uniti) | Placebo + SFU | +1.01 | 48 | |
| GLYSET 25 mg t.i.d. + SFU | +0.71 | -0.30 | -2 | -50†|
| GLYSET 50 mg t.i.d. + SFU | +0.39 | -0.62†| -13 | -61†|
| GLYSET 100 mg t.i.d. + SFU | +0.28 | -0.73†| -33 | -81†|
| 8 (non statunitensi) | Placebo + SFU | +0.16 | +10 | |
| GLYSET 100 mg t.i.d. + SFU | -0.50 | -0.66†| -36 | -46†|
| * In questi studi il basale medio variava dall'8,56 al 9,16%. ** Il risultato della sottrazione della media del gruppo placebo. *** t.i.d. = 3 volte al giorno € 0,05 |
Dose-risposta
I risultati di studi controllati a dose fissa di Glyset come monoterapia o come terapia di associazione con una sulfonilurea sono stati combinati per derivare una stima aggregata della differenza rispetto al placebo nella variazione media rispetto al basale dell'emoglobina glicosilata (HbA1c) e del glucosio plasmatico postprandiale come mostrato nelle Figure 1 e 2:
Figura 1: Variazione media di HbA1c (%) rispetto al basale: risultati aggregati degli effetti del trattamento dagli studi a dose fissa controllati nelle tabelle 1 e 2
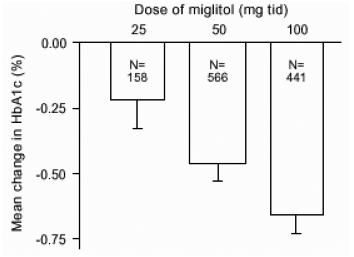
Figura 2: Variazione media del glucosio plasmatico postprandiale di 1 ora rispetto al basale: risultati aggregati degli effetti del trattamento dagli studi a dose fissa controllati nelle tabelle 1 e 2
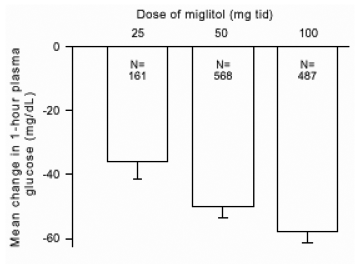
A causa del suo meccanismo d'azione, l'effetto farmacologico primario del miglitolo si manifesta come una riduzione del glucosio plasmatico postprandiale, come mostrato in precedenza in tutti i principali studi clinici. GLYSET era statisticamente significativamente diverso dal placebo a tutte le dosi in ciascuno dei singoli studi per quanto riguarda l'effetto sulla glicemia postprandiale media di un'ora e vi è una risposta di dose da 25 a 100 mg 3 volte al giorno per questa efficacia parametro.
superiore
Indicazioni e utilizzo
Le compresse di Glyset, in monoterapia, sono indicate in aggiunta alla dieta per migliorare il controllo glicemico pazienti con diabete mellito non insulino-dipendente (NIDDM) la cui iperglicemia non può essere gestita con dieta da sola. Glyset può anche essere usato in combinazione con una sulfonilurea quando la dieta più Glyset o una solfonilurea da sola non danno un adeguato controllo glicemico. L'effetto di Glyset per migliorare il controllo glicemico è additivo a quello delle sulfaniluree quando usato in combinazione, presumibilmente perché il suo meccanismo d'azione è diverso.
Nell'avvio del trattamento per NIDDM, la dieta deve essere enfatizzata come la forma primaria di trattamento. La restrizione calorica e la perdita di peso sono essenziali nel paziente diabetico obeso. Una corretta gestione della dieta da sola può essere efficace nel controllo della glicemia e dei sintomi di iperglicemia. È inoltre opportuno sottolineare l'importanza di un'attività fisica regolare, se del caso. Se questo programma di trattamento non riesce a determinare un adeguato controllo glicemico, deve essere preso in considerazione l'uso di Glyset. L'uso di Glyset deve essere considerato sia dal medico che dal paziente come un trattamento in aggiunta alla dieta e non come un sostituto della dieta o come un meccanismo conveniente per evitare la limitazione dietetica.
superiore
Controindicazioni
Le compresse GLYSET sono controindicate nei pazienti con:
- Chetoacidosi diabetica
- Malattia infiammatoria intestinale, ulcerazione del colon o ostruzione intestinale parziale e in pazienti predisposti all'ostruzione intestinale
- Malattie intestinali croniche associate a marcati disturbi della digestione o dell'assorbimento o a condizioni che possono deteriorarsi a causa di una maggiore formazione di gas nell'intestino
- Ipersensibilità al farmaco o ad uno dei suoi componenti.
superiore
Precauzioni
Generale
L'ipoglicemia
A causa del suo meccanismo d'azione, GLYSET quando somministrato da solo non deve causare ipoglicemia a digiuno o postprandiale. Gli agenti di sulfonilurea possono causare ipoglicemia. Poiché le compresse GLYSET somministrate in associazione con una sulfonilurea causeranno un ulteriore abbassamento della glicemia, può aumentare il potenziale ipoglicemico della sulfonilurea, sebbene ciò non sia stato osservato in ambito clinico prove. Il glucosio orale (destrosio), il cui assorbimento non è ritardato da GLYSET, deve essere usato al posto del saccarosio (zucchero di canna) nel trattamento dell'ipoglicemia da lieve a moderata. Il saccarosio, la cui idrolisi del glucosio e del fruttosio è inibito da GLYSET, non è adatto per la rapida correzione dell'ipoglicemia. L'ipoglicemia grave può richiedere l'uso di infusione di glucosio per via endovenosa o iniezione di glucagone.
Perdita di controllo del glucosio nel sangue
Quando i pazienti diabetici sono esposti a stress come febbre, traumi, infezioni o interventi chirurgici, può verificarsi una temporanea perdita di controllo della glicemia. In tali momenti, può essere necessaria una terapia insulinica temporanea.
Insufficienza renale
Le concentrazioni plasmatiche di GLYSET nei volontari con insufficienza renale sono state proporzionalmente aumentate rispetto al grado di disfunzione renale. Non sono stati condotti studi clinici a lungo termine su pazienti diabetici con disfunzione renale significativa (creatinina sierica> 2,0 mg / dL). Pertanto, il trattamento di questi pazienti con GLYSET non è raccomandato.
Informazioni per i pazienti
Le seguenti informazioni devono essere fornite ai pazienti:
- Glyset deve essere assunto per via orale tre volte al giorno all'inizio (con il primo morso) di ciascun pasto principale. È importante continuare ad aderire alle istruzioni dietetiche, a un programma di allenamento regolare e ai test regolari delle urine e / o della glicemia.
- Lo stesso Glyset non causa ipoglicemia anche se somministrato a pazienti a digiuno. I farmaci e l'insulina sulfanilurea, tuttavia, possono abbassare i livelli di zucchero nel sangue abbastanza da causare sintomi o talvolta ipoglicemia potenzialmente letale. Poiché Glyset somministrato in associazione con una sulfonilurea o insulina causerà un ulteriore abbassamento della glicemia, può aumentare il potenziale ipoglicemico di questi agenti. Il rischio di ipoglicemia, i suoi sintomi e il trattamento e le condizioni che predispongono al suo sviluppo devono essere ben compresi dai pazienti e dai familiari responsabili. Poiché Glyset impedisce la scomposizione dello zucchero da tavola, una fonte di glucosio (destrosio, D-glucosio) dovrebbe essere prontamente disponibile per il trattamento dei sintomi di ipoglicemia durante l'assunzione di Glyset in associazione con una sulfonilurea o insulina.
- Se si verificano effetti collaterali con Glyset, di solito si sviluppano durante le prime settimane di terapia. Sono più comunemente effetti gastrointestinali da dose lieve a moderata, come flatulenza, morbidezza feci, diarrea o fastidio addominale e generalmente diminuiscono in frequenza e intensità tempo. L'interruzione di una preparazione di solito porta a una rapida risoluzione di questi sintomi gastrointestinali.
Test di laboratorio
La risposta terapeutica a GLYSET può essere monitorata mediante test periodici della glicemia. Si raccomanda la misurazione dei livelli di emoglobina glicosilata per il monitoraggio del controllo glicemico a lungo termine.
In 12 maschi sani, l'antiacido somministrato in concomitanza non ha influenzato la farmacocinetica del miglitolo.
Interazioni farmacologiche
Diversi studi hanno studiato la possibile interazione tra miglitolo e gliburide. In sei volontari sani è stata somministrata una singola dose di 5 mg di gliburide su uno sfondo di 6 giorni di trattamento con miglitolo (50 mg 3 volte al giorno per 4 giorni seguito da 100 mg 3 volte al giorno per 2 giorni) o placebo, la media Cmax e valori di AUC per il gliburide erano rispettivamente del 17% e del 25% inferiori, quando il gliburide veniva somministrato con miglitolo. In uno studio su pazienti diabetici in cui gli effetti dell'aggiunta di miglitolo 100 mg 3 volte al giorno × 7 giorni o di placebo a un regime di fondo di 3,5 mg di gliburide sono stati studiati quotidianamente, il valore medio di AUC per glicburide era inferiore del 18% nel gruppo trattato con miglitolo, sebbene questa differenza non fosse statisticamente significativo. Ulteriori informazioni su una potenziale interazione con glyburide sono state ottenute da uno dei grandi studi clinici statunitensi (Studio 7) in cui i pazienti sono stati dosati con miglitolo o placebo su uno sfondo di glyburide 10 mg due volte al giorno. Alle visite cliniche di 6 mesi e 1 anno, i pazienti che assumevano contemporaneamente miglitolo 100 mg 3 volte al giorno hanno mostrato media Cmax valori per glyburide che erano rispettivamente del 16% e dell'8% inferiori, rispetto ai pazienti che assumevano solo glyburide. Tuttavia, queste differenze non erano statisticamente significative. Pertanto, sebbene vi sia stata una tendenza verso AUC e C inferiorimax valori per glyburide quando somministrato in concomitanza con Glyset, nessuna affermazione definitiva su una potenziale interazione può essere fatta sulla base dei precedenti tre studi.
L'effetto del miglitolo (100 mg 3 volte al giorno × 7 giorni) sulla farmacocinetica di una singola dose da 1000 mg di metformina è stato studiato in volontari sani. AUC e C medimax i valori di metformina erano inferiori dal 12% al 13% quando ai volontari veniva somministrato miglitolo rispetto al placebo, ma questa differenza non era statisticamente significativa.
In uno studio su volontari sani, la co-somministrazione di 50 mg o 100 mg di miglitolo 3 volte al giorno insieme alla digossina ha ridotto le concentrazioni plasmatiche medie di digossina del 19% e del 28%, rispettivamente. Tuttavia, nei pazienti diabetici in trattamento con digossina, le concentrazioni plasmatiche di digossina non sono state alterate dalla somministrazione concomitante di miglitolo 100 mg 3 volte al giorno per 14 giorni.
Altri studi volontari sani hanno dimostrato che il miglitolo può ridurre significativamente la biodisponibilità di ranitidina e propranololo del 60% e 40%, rispettivamente. Non è stato osservato alcun effetto del miglitolo sulla farmacocinetica o farmacodinamica del warfarin o della nifedipina.
Assorbenti intestinali (ad es. Carbone) e preparazioni di enzimi digestivi contenenti enzimi che spaccano i carboidrati (ad es. amilasi, pancreatina) possono ridurre l'effetto di Glyset e non dovrebbero essere preso in concomitanza.
In 12 maschi sani, l'antiacido somministrato in concomitanza non ha influenzato la farmacocinetica del miglitolo.
Cancerogenesi, mutagenesi e alterazione della fertilità
Il miglitolo è stato somministrato ai topi per via dietetica a dosi fino a circa 500 mg / kg peso corporeo (corrispondente a un'esposizione maggiore di 5 volte nell'uomo sulla base dell'AUC) per 21 mesi. In uno studio di due anni sul ratto, il miglitolo è stato somministrato nella dieta a esposizioni paragonabili alle esposizioni umane massime basate sull'AUC. Non ci sono prove di cancerogenicità derivante dal trattamento dietetico con miglitolo.
In vitro, il miglitolo è risultato non mututageno nel test di mutagenesi batterica (Ames) e nel test di mutazione eucariotica in avanti (CHO / HGPRT). Il test del micronucleo del topo non ha avuto effetti clastogenici in vivo nel miglitolo. Non sono state rilevate mutazioni ereditarie nel test letale dominante.
Uno studio combinato sulla fertilità maschile e femminile condotto su ratti Wistar trattati per via orale con miglitolo a dosi di 300 mg / kg di peso corporeo (circa 8 volte la massima esposizione umana in base alla superficie corporea) non ha prodotto alcun effetto indesiderato sulle prestazioni o capacità riproduttive da riprodurre. Inoltre, la sopravvivenza, la crescita, lo sviluppo e la fertilità della prole non sono state compromesse.
Gravidanza
Effetti teratogeni
Categoria di gravidanza B
La sicurezza di GLYSET nelle donne in gravidanza non è stata stabilita. Sono stati condotti studi tossicologici sullo sviluppo nei ratti a dosi di 50, 150 e 450 mg / kg, corrispondenti a livelli di circa 1,5, 4 e 12 volte l'esposizione umana massima consigliata in base alla superficie corporea la zona. Nei conigli sono state esaminate dosi di 10, 45 e 200 mg / kg corrispondenti a livelli di circa 0,5, 3 e 10 volte l'esposizione umana. Questi studi non hanno rivelato alcuna evidenza di malformazioni fetali attribuibili al miglitolo. Dosi di miglitolo fino a 4 e 3 volte la dose nell'uomo (in base alla superficie corporea), rispettivamente per ratti e conigli, non hanno rivelato evidenza di ridotta fertilità o danno al feto. Le dosi più elevate testate in questi studi, 450 mg / kg nel ratto e 200 mg / kg nel coniglio hanno favorito la tossicità materna e / o fetale. La fetotossicità è stata indicata da una leggera ma significativa riduzione del peso fetale nello studio sui ratti e da una leggera riduzione peso fetale, ossificazione ritardata dello scheletro fetale e aumento della percentuale di feti non vitali nel coniglio studia. Nello studio peri-postnatale nei ratti, il NOAEL (No Observed Adverse Effect Level) era di 100 mg / kg (corrispondente a circa quattro volte l'esposizione all'uomo, in base alla superficie corporea). È stato osservato un aumento della progenie dei nati morti alla dose elevata (300 mg / kg) nel ratto peri-postnatale studio, ma non alla dose elevata (450 mg / kg) nel segmento di consegna della tossicità per lo sviluppo del ratto studia. Altrimenti, non sono stati osservati effetti avversi sulla sopravvivenza, sulla crescita, sullo sviluppo, sul comportamento o sulla fertilità né negli studi sulla tossicità sullo sviluppo del ratto né negli studi peri-postnatali. Non esistono, tuttavia, studi adeguati e ben controllati su donne in gravidanza. Poiché gli studi sulla riproduzione animale non sono sempre predittivi della risposta umana, questo farmaco deve essere usato durante la gravidanza solo se chiaramente necessario.
Madri che allattano
È stato dimostrato che il miglitolo viene escreto nel latte materno in misura molto ridotta. L'escrezione totale nel latte rappresentava lo 0,02% di una dose materna di 100 mg. L'esposizione stimata a un lattante è di circa lo 0,4% della dose materna. Sebbene i livelli di miglitolo raggiunti nel latte materno siano estremamente bassi, si raccomanda di non somministrare GLYSET a donne che allattano.
Uso pediatrico
La sicurezza e l'efficacia di GLYSET nei pazienti pediatrici non sono state stabilite.
Uso geriatrico
Del numero totale di soggetti negli studi clinici su GLYSET negli Stati Uniti, i pazienti validi per le analisi di sicurezza includevano il 24% su 65 e il 3% su 75. Non sono state osservate differenze generali in termini di sicurezza ed efficacia tra questi soggetti e soggetti più giovani. La farmacocinetica del miglitolo è stata studiata in maschi anziani e giovani (n = 8 per gruppo). Alla dose di 100 mg 3 volte al giorno per 3 giorni, non sono state riscontrate differenze tra i due gruppi.
superiore
Reazioni avverse
gastrointestinale
I sintomi gastrointestinali sono le reazioni più comuni alle compresse GLYSET. Negli studi statunitensi controllati con placebo, l'incidenza di dolore addominale, diarrea e flatulenza è stata rispettivamente dell'11,7%, del 28,7% e del 41,5% nel 962 pazienti trattati con GLYSET 25-100 mg 3 volte al giorno, mentre le incidenze corrispondenti sono state del 4,7%, 10,0% e 12,0% in 603 trattati con placebo pazienti. L'incidenza di diarrea e dolore addominale tendeva a diminuire considerevolmente con il proseguimento del trattamento.
dermatologica
Eruzioni cutanee sono state riportate nel 4,3% dei pazienti trattati con GLYSET rispetto al 2,4% dei pazienti trattati con placebo. Le eruzioni cutanee erano generalmente transitorie e la maggior parte sono state valutate come non correlate a GLYSET da medici-investigatori.
Risultati di laboratorio anormali
Il ferro sierico basso si è verificato più spesso nei pazienti trattati con GLYSET (9,2%) rispetto ai pazienti trattati con placebo (4,2%) ma non persistono nella maggior parte dei casi e non sono stati associati a riduzioni dell'emoglobina o cambiamenti in altri indici ematologici.
superiore
sovradosaggio
A differenza delle sulfoniluree o dell'insulina, un sovradosaggio di GLYSET compresse non provoca ipoglicemia. Un sovradosaggio può causare aumenti transitori di flatulenza, diarrea e disagio addominale. A causa della mancanza di effetti extra-intestinali osservati con GLYSET, non si prevedono gravi reazioni sistemiche in caso di sovradosaggio.
superiore
Dosaggio e amministrazione
Non esiste un regime posologico fisso per la gestione del diabete mellito con GLYSET compresse o qualsiasi altro agente farmacologico. Il dosaggio di GLYSET deve essere personalizzato in base sia all'efficacia che alla tolleranza senza superare la dose massima raccomandata di 100 mg 3 volte al giorno. GLYSET deve essere assunto tre volte al giorno all'inizio (con il primo morso) di ciascun pasto principale. GLYSET deve essere iniziato a 25 mg e il dosaggio aumenta gradualmente come descritto di seguito, entrambi per ridurre effetti avversi gastrointestinali e consentire l'identificazione della dose minima richiesta per un adeguato controllo glicemico del paziente.
Durante l'inizio del trattamento e la titolazione della dose (vedere sotto), può essere il glucosio plasmatico postprandiale di un'ora utilizzato per determinare la risposta terapeutica a GLYSET e identificare la dose minima efficace per il paziente. Successivamente, l'emoglobina glicosilata deve essere misurata ad intervalli di circa tre mesi. L'obiettivo terapeutico dovrebbe essere quello di ridurre i livelli di glicemia postprandiale e di emoglobina glicosilata alla normalità o quasi normale usando la dose efficace più bassa di GLYSET, in monoterapia o in associazione con una sulfonilurea.
Dosaggio iniziale
La dose iniziale raccomandata di GLYSET è di 25 mg, somministrata per via orale tre volte al giorno all'inizio (con il primo morso) di ciascun pasto principale. Tuttavia, alcuni pazienti possono trarre beneficio iniziando da 25 mg una volta al giorno per ridurre al minimo gli effetti avversi gastrointestinali e aumentando gradualmente la frequenza di somministrazione a 3 volte al giorno.
Dosaggio di mantenimento
La normale dose di mantenimento di GLYSET è di 50 mg 3 volte al giorno, sebbene alcuni pazienti possano trarre beneficio dall'aumentare la dose a 100 mg 3 volte al giorno. Al fine di consentire l'adattamento ai potenziali effetti avversi gastrointestinali, si raccomanda di effettuare la terapia con GLYSET iniziato ad un dosaggio di 25 mg 3 volte al giorno, il dosaggio efficace più basso, e poi gradualmente titolato verso l'alto per consentire adattamento. Dopo 4-8 settimane del regime di 25 mg 3 volte al giorno, il dosaggio deve essere aumentato a 50 mg 3 volte al giorno per circa tre mesi, dopo i quali un livello di emoglobina glicosilata deve essere misurato per valutare la terapia risposta. Se, a quel tempo, il livello di emoglobina glicosilata non è soddisfacente, il dosaggio può essere ulteriormente aumentato a 100 mg 3 volte al giorno, il dosaggio massimo raccomandato. Dati aggregati provenienti da studi controllati suggeriscono una dose-risposta sia per HbA1c sia per glucosio plasmatico postprandiale di un'ora nell'intervallo di dosaggio raccomandato. Tuttavia, nessuno studio singolo ha esaminato l'effetto sul controllo glicemico della titolazione delle dosi dei pazienti verso l'alto all'interno dello stesso studio. Se non si osserva alcuna ulteriore riduzione dei livelli di glucosio postprandiale o di emoglobina glicosilata con titolazione a 100 mg 3 volte al giorno, si deve prendere in considerazione una riduzione della dose. Una volta stabilito un dosaggio efficace e tollerato, deve essere mantenuto.
Dosaggio massimo
Il dosaggio massimo raccomandato di GLYSET è di 100 mg 3 volte al giorno. In uno studio clinico, 200 mg 3 volte al giorno hanno dato un ulteriore controllo glicemico migliorato, ma hanno aumentato l'incidenza dei sintomi gastrointestinali sopra descritti.
Pazienti che ricevono sulfoniluree
Gli agenti di sulfonilurea possono causare ipoglicemia. Non è stata osservata una maggiore incidenza di ipoglicemia nei pazienti che hanno assunto GLYSET in associazione con sulfonilurea agenti rispetto all'incidenza di ipoglicemia nei pazienti trattati con sole sulfoniluree in qualsiasi clinica prova.
Tuttavia, GLYSET somministrato in associazione con una sulfonilurea provoca un ulteriore abbassamento della glicemia e può aumentare il rischio di ipoglicemia a causa degli effetti additivi dei due agenti. Se si verifica ipoglicemia, devono essere effettuati adeguati aggiustamenti nel dosaggio di questi agenti.
superiore
Come viene fornito
Le compresse di GLYSET sono disponibili in compresse rivestite con film bianche, rotonde, da 25 mg, 50 mg e 100 mg. Le compresse sono incise con la parola "GLYSET" su un lato e la forza sull'altro lato, come indicato di seguito.
| Forza | NDC | Identificazione tablet | |
| Davanti | Indietro | ||
| Bottiglie da 100: | |||
| 25 mg | 0009-5012-01 | Glyset | 25 |
| 50 mg | 0009-5013-01 | Glyset | 50 |
| 100 mg | 0009-5014-01 | Glyset | 100 |
Conservare a 25 ° C (77 ° F); escursioni consentite a 15 ° -30 ° C (59 ° -86 ° F) [vedi temperatura ambiente controllata USP].
Solo Rx

Fabbricato da:
Bayer HealthCare AG
Leverkusen, Germania
Glyset è un marchio registrato di Bayer HealthCare Pharmaceuticals Inc utilizzato su licenza.
LAB-0167-6,0
ultimo aggiornamento 05/2008
Glyset, miglitol, informazioni per il paziente (in inglese semplice)
Informazioni dettagliate su segni, sintomi, cause, trattamenti del diabete
Le informazioni contenute in questa monografia non intendono coprire tutti i possibili usi, indicazioni, precauzioni, interazioni farmacologiche o effetti avversi. Questa informazione è generalizzata e non è intesa come consulenza medica specifica. Se ha domande sui medicinali che sta assumendo o desidera maggiori informazioni, consultare il medico, il farmacista o l'infermiere.
torna a: Sfoglia tutti i farmaci per il diabete


